一种离子晶体的晶胞如右图。其中阳离子A以 表示,阴离子B以
表示,阴离子B以 表示。
表示。
(1)每个晶胞种含A离子的数目为________,含B离子数目为________。
(2)若A的核外电子排布与Ar相同,B的电子排布与Ne相同,则该离子化合物的化学式是___________________;
(3)阳离子的配位数为_________,阴离子的配位数为________。
(4)已知A的离子半径为0.99×10-10m,则该晶胞的体积是_______________m3。
(每空2分,共12分)
目前世界上比较先进的电解制碱技术是离子交换法,如图为离子交换膜法电解饱和食盐水的原理示意图。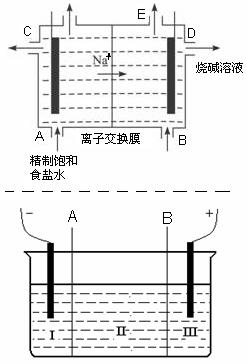
(1)下列说法不正确的是
| A.从E口逸出的气体是H2 |
| B.从B口加入含少量NaOH的水溶液以增强导电性 |
| C.标准状况下每生成22.4 L Cl2,便产生2 mol NaOH |
| D.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加 Na2CO3溶液 |
(2)现有离子交换膜A和B将电解槽分为I、II、III三个区域(下图所示),在这种电解池中电解Na2SO4溶液可 制得氢氧化钠、硫酸等物质。A为离子交换膜、B为离子交换膜(填“阴”或“阳”),电极均为惰性电极。Na2SO4溶液应该在区(填“I”、“II”、“III”)加入。通电电解时阴极的电极反应式为
制得氢氧化钠、硫酸等物质。A为离子交换膜、B为离子交换膜(填“阴”或“阳”),电极均为惰性电极。Na2SO4溶液应该在区(填“I”、“II”、“III”)加入。通电电解时阴极的电极反应式为 ,在III区得到。当外电路总共通过30 mol电子时,生成的NaOH 960克,则电解过程中能量的转化率为:
,在III区得到。当外电路总共通过30 mol电子时,生成的NaOH 960克,则电解过程中能量的转化率为:
Ⅰ、A物质的化学式为M(OH)2,将其溶于水制成稀溶液,该溶液呈中性,在溶液中存在:
M2+ + 2OH- M(OH)2
M(OH)2 2H+ + MO22-
2H+ + MO22-
回答以下题目一律用“增大”“减小”“不变 ”填空
”填空
(1)在其他条件不变的情况下,25Co时,在蒸馏水中加入A物质后,与加入前比较,
①由水电离出的C(OH-),C(H+),水的电离度,Kw
(2)25Co时,向A的稀溶液中加入少量的烧碱固体。
则水的电离度,溶液的pH
Ⅱ、.室温下,甲、乙两瓶氨水的浓度分别为1mol/L和0.1mol/L,则甲、乙两瓶氨水中C(OH-)之比为10 (填大于、等于或小于)
(15分)
合成氨对化学工业和国防工业具有重要意义。
(1)向合成塔中按1:4的物质的量之比充入N2、H2进行氨的合成,图A为T0C时平衡混合物中氨气的体积分数与压强(P)的关系图。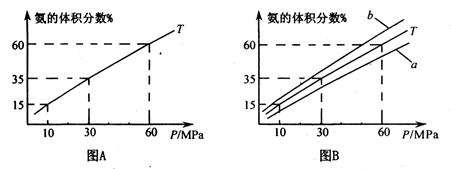
①写出工业上合成氨的化学方程式_____________________。
②图A中氨气的体积分数为15.00%时,H2的转化率="_______" 。
③图B中T=5000C,温度为4500C对应的曲线是_______(选填字母“a"或“b ”),选择的理由是______________
④由图像知,增大压强可提高原料的利用率,从生产实际考虑增大压强需解决的问题是_______(写出一条即可)。
(2)合成氨 所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:
所需的氢气可由甲烷与水反应制得,反应的热化学方程式为: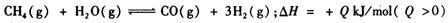
(3)一定温度下,在2 L容器中发生上述反应,各 物质的物质的量变化如下表
物质的物质的量变化如下表
| 时间/min |
CH4(mol) |
H20( mol) |
CO (mol) |
H2 (mol) |
| 0 |
0.40 |
1.00 |
0 |
0 |
| 5 |
X1 |
X2 |
X3 |
0.60 |
| 7 |
Y1 |
Y2 |
0.20 |
Y3 |
| 10 |
0.21 |
0.81 |
0.19 |
0.62 |
①分析表中数据,判断5〜7min之间反应是否处于平衡状态____________(填“是”或“否”),
前5 min平均反应速率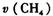 =______。
=______。
②反应在7~ 10 min之间,CO的物质的量减少的原因可能是______(填字母)。
a•减少CH4 b•降低温度 c•增大压强 d•充入H 2
2
③若保持温度不变,向1L容器中起始充入0.15 mol CH4.0.45 mol H2O. ______mol CO、______mol H2 ,达到平衡时CH4的体积百分含量与第一次投料相同。
一定条件下,物质A~E转化关系如图,其中A为单质,常温下E为无色液体。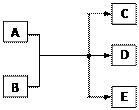
(1)若A、C、D均含氯元素,C为氯碱工业的原料,
D溶液具有漂白性,则A与B反应的化学方程式是;D溶液可使KI淀粉溶液显蓝色,则D与KI在溶液中反应的离子方程式是;过量B溶液与NH4HCO3溶液共热,生成气体G的离子方程式是,G遇硝酸蒸气的现象是。
(2)若A为红色金属,B为某酸的浓溶液,D可形成酸雨的无色气体。A与B反应的化学是;a molA与足量的B充分反应后,将产生的D通入NaOH溶液中,恰好完全反应,则所需NaOH的物质的量的范围是。
(3)上述(1)、(2)中的D都能使品红溶液褪色,利用褪色后的溶液,探究使品红溶液褪色的物质的实验方法是。
PMA是某种人工合成的有机高分子化合物,有多种用途。以来源于石油裂解气的甲为原料,通过以下途径合成PMA:
已知:化合物丙相对分子质量为90,碳的质量分数为40%、氢的质量分数为6.67%,其余为氧。试完成下列问题:
(1)甲的结构简式为。
(2)完成下列反应方程式、指出反应类型
反应②、;
反应⑧、;
(3)⑤反应的化学方程式是:。
(4)丙有多种同分异构体,写出一个同时满足①不能发生水解反应;②能发生银镜反应;③有某种相同官能团且不连在同一个碳原子上。三个条件的同分异构体的结构简式:。