右表是元素周期表的一部分。(共7分)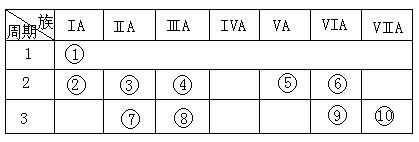
(1)表中元素⑩的氢化物的化学式为 ,此氢化物的还原性比元素⑨的氢化物的还原性 (填强或弱)
(2)某元素原子的核外p电子数比s电子数少1,则该元素的元素符号是 ,其单质的电子式为 。
(3)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式
又如表中与元素⑦的性质相似的不同族元素是 (填元素符号)
下列各组粒子,属于同种核素的是(填编号,下同),互为同位素的是,互为同素异形体的是,互为同分异构体的是。
①16O2和18O3②质子数相同而中子数不同的两种粒子
③ ④
④ 和
和 (核内15个中子)
(核内15个中子)
⑤葡萄糖和果糖⑥
某同学按下列步骤配制500 mL 0.2 mol·L-1 KCl溶液,请回答有关问题。
| 实验步骤 |
有关问题 |
| ①计算所需KCl的质量 |
需要KCl的质量为________g(保留小数点后一位) |
| ②称量KCl固体 |
称量需要用到的主要仪器是________________ |
| ③将KCl加入100 mL烧杯中,并加入适量水 |
为了加快溶解速率,可以采取哪些措施? ________________ |
| ④将烧杯中溶液转移至500 mL容量瓶中 |
为了防止溶液溅出,应采取什么措施? __________________ |
| ⑤向容量瓶中加蒸馏水至刻度线 |
在进行此操作时当加水至离刻度线1 cm~2 cm处应如何操作?____________________ |
(1)上述实验中使用容量瓶前应检验_________________________________________________。
(2)在进行④步操作时未将洗涤烧杯、玻璃棒的洗涤液转移至容量瓶,则配制溶液浓度
________(填“偏高”、“偏低”或“不影响”)。
(3)若进行⑤步操作时加蒸馏水超过刻度线,则需________。
(1)在标准状况下,a.6.72 L CH4气体 b.3.01×1023个HCl气体分子 c.13.6g H2S气体 d.0.2mol NH3,下列对这四种气体的关系从大到小的排列是(用上述序号表示)。
①四种气体的物质的量___________________________________;
②标准状况下四种气体的密度_____________________________;
③四种气体的质量_______________________________________。
(2)阿伏加德罗曾做过这样一个实验:一抽空的密闭容器重Mg,在标准状况下,盛满以相同物质的量混合的NO和H2的混合气体后,称量为(M+Q)g。把混合气体排尽,再充满SO2气体,为使天平平衡,应在托盘天平的________边托盘上放置________g砝码。
(3)将10g复盐CuSO4·x(NH4)2SO4·yH2O加到过量的NaOH溶液中加热,生成的氨气用100 mL 0.5mol/L硫酸全部吸收,多余的硫酸用2mol/L NaOH溶液中和,用去NaOH溶液25 mL。已知复盐中SO的质量分数为48%,则x=________,y=________。
某液体化合物X2Y4,常用做火箭燃料。16g X2Y4在一定量的O2中恰好完全燃烧,反应方程式为X2Y4(l)+O2(g)===X2(g)+2Y2O(l)。冷却后标准状况下测得生成物的体积为11.2 L,其密度为1.25g/L,则:
(1)反应前O2的体积V(O2)为________。
(2)X2的摩尔质量为________;Y元素的名称是________。
(3)若反应生成0.1mol X2,则转移电子的物质的量为________mol。
对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。
(1)现有下列6种物质:SO2,SiO2,CaO,MgO,Fe2O3,Na2O2按照不同的分类标准,它们中有一种物质与其他5种有明显的不同,请找出这种物质,并写出依据(写出两种分类方法):
①___________________________________________________;
②___________________________________________________。
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入1mol/L的FeCl3溶液,可制得一种红褐色胶体。
①反应的化学方程式为_________________________________。
②如何用较简单的方法判断胶体是否制备成功?___________________________________。
(3)若向该胶体中加入饱和(NH4)2SO4溶液,发生的现象是_________________________;
原因是_______________________________________________。