有A、B、C、D、E、F六种短周期元素,原子序数依次增大,B、C、D的阳离子、A的阴离子均具有与氖原子相同的电子层结构;A、B可形成离子化合物B2A;D的最高价氧化物既能与强酸反应,又能与强碱反应;E的原子结构示意图为: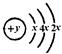 ;F的最外层电子数是电子层数的2倍。
;F的最外层电子数是电子层数的2倍。
试回答下列各问题:
(1)B元素为 (填元素符号)
(2)F元素位于元素周期表中第 周期第 族
(3)化合物B2A的电子式____________________
(4)D的最高价氧化物与B的最高价氧化物对应的水化物溶液反应的离子方程式:
(5)将C、D用导线相连浸入B的最高价氧化物对应的水化物的溶液中,形成原电池,正极的电极反应为
下表是元素周期表的一部分,按要求填空:
| 族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
|
| 4 |
⑩ |
⑪ |
⑫ |
(1)写出下列元素的元素符号:① _______ ②_______ _⑪_______
(2)写出下列元素的名称,最活泼的金属元素是__ ___,最活泼的非金属元素是____ ,
(3)用化学式表示在这些元素的最高价氧化物对应水化物中,酸性最强的是,
碱性最强的是,呈两性的氢氧化物是。
(4)在③与④的单质中,用元素符号表示化学性质较活泼的是,实验验证方法是;在⑧与⑫的单质中,用元素符号表示化学性质较为活泼的是,实验验证的方法是
乙炔(C2H2)是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2中C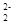 与O
与O 互为等电子体,等电子体结构相似,则1 个O
互为等电子体,等电子体结构相似,则1 个O 中含有的π键数目为。
中含有的π键数目为。
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为
。
(3)乙炔与氢氰酸反应可得丙烯腈( H2C=CH—C≡N )。丙烯腈分子中碳原子轨道杂化类型是;分子中处于同一直线上的原子数目最多为________。
某元素原子的最外电子层只有一个电子,该电子的电子层数n=4。
请回答下列问题:
(1)符合上述条件的元素共有______种。
(2)在符合上述条件的元素中,原子序数最小的在周期表的________区(用符号填空),原子序数最大的在周期表的第_____周期、____族。
(3) 过渡元素的金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d0或d10排布时,无颜色,为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+颜色(填“无”或“有”)。
(4)符合上述条件的元素中,原子序数最大、且与水分子形成的配合物有颜色的简单离子的符号为。
处于同一短周期A、B、C、D四种元素,在同族元素中,A的气态氢化物的沸点最高,B的最高价氧化物对应的水化物的酸性在同周期中是最强的,C的电负性介于A、B之间,且A是周期表中电负性最强的元素,D与B相邻。
请填空:
(1)在B的单质分子中存在________个π键,________个σ键;
(2)已知B的气态氢化物很容易与H+结合,此时B原子与H+间形成的键称为________,形成的离子立体构型为;
(3)在A、B、C、D四种元素形成的四种氢化物中的电子数均相同,其中沸点最低的是________(写分子式),其沸点显著低于其他三种氢化物的原因是;
(4)A的氢化物易溶于水,原因是。
描述一个原子轨道要用_______,_______,_______三个方面(填量子符号)。
3d能级中原子轨道的电子层数是________,该能级的原子轨道最多可以有________个空间伸展方向,最多可容纳________个电子。