下列实验操作或叙述正确的是 (填序号)
| A.乙醇中含有少量水可加入生石灰再蒸馏制得无水乙醇 |
| B.将无水乙醇和浓硫酸按体积比1∶3混合,加热至140℃制取乙烯 |
| C.为证明溴乙烷分子中溴元素的存在,可向溴乙烷中加入NaOH溶液,加热,加入稀硝酸至溶液呈酸性,加入AgNO3溶液,看是否有淡黄色沉淀 |
| D.向碘水中加入酒精,萃取碘水中的碘 |
E.用饱和食盐水代替水与电石制备乙炔,目的是为了减缓反应速率
F.将乙烯分别通入酸性KMnO4溶液和溴水中均褪色,褪色原理相同
下图为某加碘盐标签的一部分。
已知:①KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O②I2+2Na2S2O3=2NaI+Na2S4O6(无色)
某同学想定量测定此加碘盐中碘元素的含量,进行以下实验:
步骤1:称取ag市售食盐,配成溶液,全部转移至锥形瓶中,加入适量新制KI溶液,滴入几滴稀硫酸,溶液变黄色,再加入3滴淀粉溶液。
步骤2:取一支50mL碱式滴定管,用bmol·L-1的新制Na2S2O3 溶液润洗2~3次后,装满溶液,调节液面高度至0刻度。
步骤3:开始滴定直至终点,重复操作2~3次,实验数据记录如下: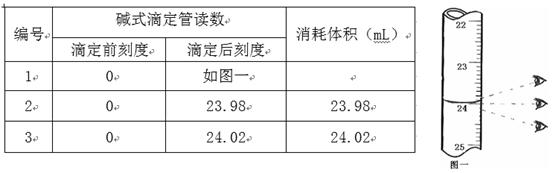
(1)第一次读数为mL。
(2)滴定终点的判断方法。
(3)经过计算,此碘盐碘元素的含量为mg·kg-1(用含a、b的最简表达式表示) 。
(4)下列操作可能会导致测量结果偏低的是。
| A.步骤1中称取食盐时将砝码放在左盘,食盐放在放在右盘,游码读数为0.5g |
| B.步骤1所配食盐溶液未完全转移至锥形瓶 |
| C.步骤2中滴定管洗涤后未润洗 |
| D.步骤3滴定前滴定管尖嘴处有气泡,滴定后气泡消失 |
(5)请在答题纸的方框内画出正在排气泡的碱式滴定管(仅画出刻度以下部分)
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有。
(2)硫酸铜溶液可以加快氢气生成速率的原因是。
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 混合液 |
A |
B |
C |
D |
E |
F |
| 4mol·L-1H2SO4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液/mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O/mL |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
①请完成此实验设计,其中:V1=,V6=,V9=。
②反应一段时间后,实验E中的金属呈色。
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因。
(12分)中华人民共和国国家标准规定葡萄酒中SO2最大使用量为0.25g·L-1。某兴趣小组用下图装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
(可能用到的相对原子质量:H—1 O—16 S—32) (1)仪器B的名称是,水通入A的进口为。
(1)仪器B的名称是,水通入A的进口为。
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,写出该反应的离子方程式:。
(3)除去C中过量的H2O2,然后用0.0900mol·L-1NaOH标准溶液进行滴定,若滴定终点时溶液的pH=8.8,则选择的指示剂为;若滴定的实验操作如下:
①检查滴定管是否漏水
②用标准液润洗盛标准液的滴定管
③装标准溶液并调整液面(记录初读数)
④用蒸馏水洗涤玻璃仪器
⑤把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇至滴定终点,记下滴定管液面刻度。
则滴定操作的正确顺序是(用序号填写)____________________________;
(4)用标准NaOH溶液滴定时,以下操作引起误差偏大的是。
| A.滴定前仰视,滴定后俯视 |
| B.盛标准液的滴定管用蒸馏水洗后未用标准液润洗 |
| C.颜色改变立即读数 |
| D.盛标准液的滴定管滴前尖嘴部分有气泡,终了无气泡 |
(5)滴定至终点时,消耗NaOH溶液20.00mL,该葡萄酒中SO2含量为g·L-1
(10分)(1)下图所示是中学化学常用的玻璃仪器,请在下列操作中填入相应的仪器
①从氯化钠溶液中获得氯化钠晶体______。
②分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物______。
(2)实验室需用230ml 1.0mol/L的NaOH溶液
①在配制溶液过程中,上述仪器中还缺少的玻璃仪器是:________________玻璃捧等。
②计算需称量的NaOH固体质量为________________g
③配制过程中,下列操作情况会使结果偏低的是
| A.溶解后未冷却直接转移至容量瓶,立即定容 |
| B.转移溶液后,未洗涤烧杯和玻璃棒就直接定容 |
| C.定容时,俯视容量瓶刻度线观察液面 |
| D.定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,继续加水定容 |
(3)若1.0mol/LNaOH溶液的密度为1.1g/cm3,则质量分数为__________%
羟基是重要的官能团。某化学小组以下列4种物质的溶液作为研究对象,比较不同物质的羟基中氢原子的活泼性。①碳酸②乙醇③苯酚④乙酸
I.甲同学设计并实施了如下实验方案。
| 编号 |
实验操作 |
实验现象 |
结论及解释 |
1 |
分别取4种溶液,滴加紫色石蕊溶液 |
溶液变红的是①④溶液 |
略 |
2 |
向含酚酞的NaOH溶液中,各滴加等量的②③两种溶液 |
②中无明显现象 ③中红色明显变浅 |
滴加③时反应的化学方程式: ________________________ |
3 |
用一定浓度的醋酸溶液浸泡水垢(水垢主要成分为碳酸钙) |
_______________ |
略 |
4 |
将CO2通入C6H5ONa溶液中 |
_______________ |
反应的化学方程式: _______________________ |
| 结论: 4种物质的羟基中的氢原子的活泼性由强到弱的顺序是(填序号)_____________。 |
II.乙同学在研究了甲同学的实验方案后,提出如下改进方案,能一次比较乙酸、碳酸和苯酚的羟基中氢原子的活泼性,实验仪器如下图所示。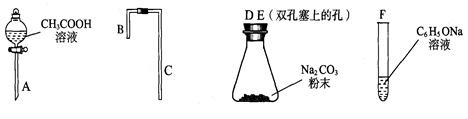
(1)利用上述仪器组装实验装置,其中A管插入(填字母,下同)______中,B管插入__________中,C管插入_________中。
(2)丙同学查资料发现乙酸有挥发性,于是在试管F之前增加了一个盛有_______溶液的洗气装置,使乙同学的实验设计更加完善。