三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末可能是Fe2O3、Cu2O或二者混合物。探究过程如下:
【查资料】Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
【提出假设】假设1:红色粉末是Fe2O3。假设2:红色粉末是Cu2O。假设3:两者混合物。
【设计探究实验】取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。
设1成立,则实验现象是__________________________________。
(2)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为
这种说法合理吗?____________,简述你的理由(不需写出反应的方程式)_______________。
(3)若粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则原固体粉末是_____________。
【探究延伸】经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再
变化时,称其质量为b g(b>a),则混合物中Cu2O的质量分数为____________________。
芳香化合物A(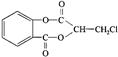 )在一定条件下可以发生如下图所示的转化(其他产物和水已略去)。
)在一定条件下可以发生如下图所示的转化(其他产物和水已略去)。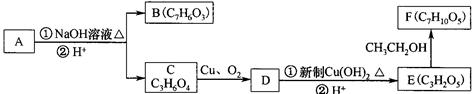
请回答下列问题:
(1)写出A的分子式 。
(2)1 molA在氢氧化钠溶液中加热,充分反应消耗氢氧化钠 mol 。
(3)写出由E制得F的化学方程式: , 反应类型是 。
(4)有机物B与乙酸酐(CH3COOCOCH3)直接反应可制得阿司匹林: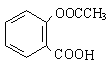
(即乙酰水杨酸,分子式 C9H8O4),满足以下条件的阿司匹林的同分异构体有 种。①苯环上只含有两个侧链
②有两个酯基
③能发生银镜反应
其中核磁共振氢谱是3:2:2:1的结构简式有 种。
(5)有机物C可以由乳酸(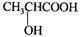 )经过几步有机反应制得,试写出以乳酸为主要原料制备有机物C的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
)经过几步有机反应制得,试写出以乳酸为主要原料制备有机物C的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
CH3CH2OH CH2=CH2
CH2=CH2 CH2CH3CH3
CH2CH3CH3
苯酚是一种重要的化工原料。以苯酚为主要起始原料,经下列反应可制得香料M和高分子化合物N。(部分产物及反应条件已略去)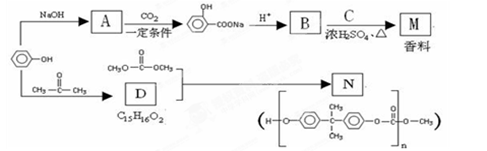
(1)写出A与CO2在一定条件下反应的化学方程式是 。
(2)B中所含官能团名称是 。
(3)已知C的分子式为C5H12O,C能与金属Na反应,C的一氯代物有2种。
①C的结构简式是 。
②B与C反应的化学方程式是 。
(4)D的结构简式是 ,生成N的反应类型是 。
(5)以苯酚为基础原料也可以合成防腐剂F。经质谱分析F的相对分子质量为152,其中氧元素的质量分数为31.58%,F完全燃烧只生成CO2和H2O。
①F的分子式是 。
②已知:
A.芳香族化合物F能与NaHCO3溶液反应,且不能发生水解反应;
B.F的核磁共振氢谱显示其分子中含有4种氢原子;
C.分子结构中不存在“-O-O-”的连接方式。
则F的结构简式是 。
(2014)非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成: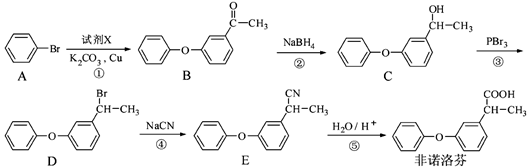
诺洛芬中的含氧官能团为 和 (填名称)。
应①中加入的试剂X的分子式为C8H8O2,X的结构简式为 。
上述五步反应中,属于取代反应的是 (填序号)。
⑷B的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ分子中有6种不同化学环境的氢,且分子中含有两个苯环。
写出该同分异构体的结构简式 。
⑸根据已有知识并结合相关信息,写出以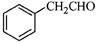 为原料制备
为原料制备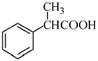 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下: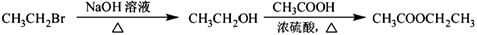
乙烯是一种重要的化工原料,以乙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去)。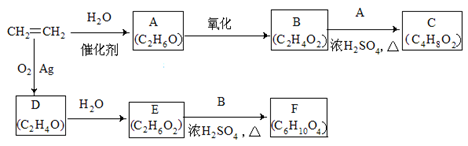
请回答下列问题:
(1)A的化学名称是 。
(2)B和A反应生成C的化学方程式为 ,该反应的类型为 。
(3)D为环状化合物,其结构简式为 。
(4)F的结构简式为 。
(5)D的同分异构体的结构简式为 。
()卤代烃在生产生活中具有广泛的应用,回答下列问题:
(1)多卤代甲烷常作为有机溶剂,其中分子结构为正四面体的是 _________ .工业上分离这些多氯代甲烷的方法是 _________ .
(2)三氟氯溴乙烷(CF3CHClBr)是一种麻醉剂,写出其所有同分异构体的结构简式_________ (不考虑立体异构).
(3)聚氯乙烯是生活中常用的塑料.工业生产聚氯乙烯的一种工艺路线如下:
反应①的化学方程式为 _________ ,反应类型为 _________ ;反应②的反应类型为 _________ .