某化学兴趣小组的同学,在学习了高中化学第三册中有关草酸的性质,查阅了大量资料,获得了草酸的一些信息,整理出下表:
| (1) 草酸晶体 |
分子式 |
H2C2O4·2H2O |
颜色 |
无色晶体 |
| 熔点 |
100.1℃ |
受热至100.1℃时失去结晶水,成为无水草酸。 |
||
| (2) 无水草酸 |
结构简式 |
HOOC—COOH |
溶解性 |
能溶于水或乙醇 |
| 特性 |
大约在157℃升华(175℃以上发生分解)。 |
|||
| 化学性质 |
H2C2O4 + Ba(OH)2 =BaC2O4↓+ 2H2O |
|||
| HOOC—COOH >175℃ CO2↑+CO↑+H2O↑ |
该组同学依据上表设计了一套如下图所示的实验装置,欲通过实验验证无水草酸受热分解的产物,并利用反应产生的CO气体来还原铁的某种氧化物(FexOy),以确定FexOy的组成。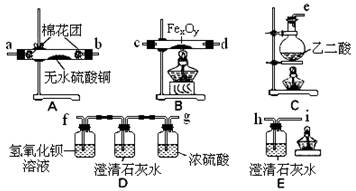
请回答下列问题:
(1)实验所需的仪器装置如上图所示,各装置的连接顺序为:
e接 、 接 、 接 、 接 h 。
(2)该组同学进行了下列实验操作:
①点燃B处的酒精灯;
②检查实验装置的气密性并装入药品;
③反应结束后,先熄灭B处的酒精灯,继续通入气体直到B中固体全部冷却后,再熄灭c处的酒精灯;
④点燃c处的酒精灯,开始反应,在装置E的i口处收集一试管气体,验纯;
⑤点燃尖嘴i处的酒精灯。
正确的实验操作顺序是: 。
(3)收集气体验纯的目的是 。
D装置中澄清石灰水的作用是 。
E装置中澄清石灰水的作用是 。
(4)反应完全后,该组同学进行数据处理。反应前,称得硬质玻璃管的质量为54.00 g,样品FexOy的质量为7.84 g;反应后,称得硬质玻璃管与剩余固体的总质量为59.60g(其质量经同样操作后也不再发生变化),则样品FexOy中,x:y= 。
(5)本实验有没有不妥之处?如果有,请答出改进的方案;若无,此问可不必答。
。
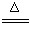
实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为 
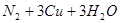
试回答:
(1)如果选用测定反应物CuO和生成物H2O的质量(m(CuO)、m(H2O))时,请用下列仪器设计一个简单的试验方案。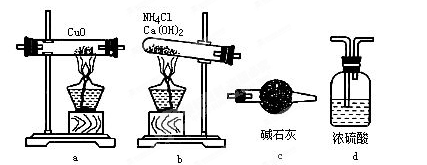
① 仪器连接的顺序(用字母编号表示,仪器可重复使用)_________;
d中浓硫酸的作用是________,______;
实验完毕时观察到a中的现象是__________;
② 列出计算Cu的相对原子质量的表达式_________;
③ 下列情况将使测定结果偏大的是________。(以下选择填空不限1个正确答案,均用字母编号填写)
A. CuO未全部还原为Cu
B. CuO受潮
C. CuO中混有Cu
(2)如果仍采用上述仪器装置,其它方案可选用测定的物理量有_______
A. m(Cu)和m(CuO) B. m(N2)和m(H2O)
C. m(Cu)m(H2O) D. m(NH3)和m(H2O)
某学生设计了三个实验方案,用以检验淀粉的水解情况。
⑴方案甲:淀粉液 水解液
水解液 中和液
中和液 溶液变蓝
溶液变蓝
结论:淀粉没有水解
⑵方案乙:淀粉液 水解液
水解液 无红色沉淀
无红色沉淀
结论:淀粉没有水解
⑶方案甲:淀粉液 水解液
水解液 中和液
中和液 有红色沉淀
有红色沉淀
结论:淀粉已水解
以上三种方案的设计及结论是否正确?如不正确,请简述理由。
实验室里用一般的气体发生装置来制备Cl2,反应物即使在停止加热后反应还会继续一段时间,当要收集多瓶Cl2时,常有较多的Cl2逸散到空气中去,为了避免Cl2的逸散,并对多余的Cl2随时取用,有人设计了如下图的甲装置来制取Cl2: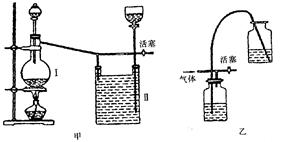
(1)设计甲装置是依据了(填已学某仪器名称)的原理。甲中装置
Ⅱ(填能或不能)用乙装置来代替。
(2)甲中Ⅱ中盛有的液体是,该装置可看作是一个(填某仪器名称),简述其主要原理:
实验室里用下图所示装置制取纯净的无水CuCl2。试回答下列问题:
(1)写出烧瓶中发生反应的化学方程式,并标出电子转移的方向和数目。
(2)B处盛有饱和食盐水(或水),其作用是。
(3)C处盛放的试剂__________(填名称),其作用是。 (4)E处盛有___________(填名称),发生反应的离子方程式为_________。
(4)E处盛有___________(填名称),发生反应的离子方程式为_________。
(5)实验结束时,应先熄灭__________处酒精灯。
“碘钟”实验中,3I-+S2O82-=I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
| 实验编号 |
① |
② |
③ |
④ |
⑤ |
| c(I-)/mol·L- |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
| c(SO42-)/mol·L- |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
| t /s |
88.0 |
44.0 |
22.0 |
44.0 |
t2 |
回答下列问题:
(1)该实验的目的是。
(2)显色时间t2=。
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为(填字母)
A <22.0sB22.0~44.0sC>44.0sD数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是。