为了从海带(含有丰富的碘)中提取碘,某研究性学习小组设计并进行了以下实验:

请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是
(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
| A.烧杯 | B.坩埚 | C.表面皿 | D.泥三角 E.酒精灯 F.干燥器 |
(2)步骤③的实验操作名称是 ;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
(3)步骤④反应的离子方程式是 。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是
。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法
。
课本实验设计得简要明了,但也常存在一些不足,在学习过程中对其进行分析与改进是研究性学习的一个重要课题。
Ⅰ.草酸晶体(H2C2O4·2H2O)受热易分解(分解温度为175℃),产生CO和CO2。关于草酸晶体受热分解及验证部分分解产物的实验装置如图。
(1)写出草酸晶体受热分解的化学方程式:
__________。
(2)设计该装置欲验证的分解产物是。
(3)草酸晶体的某些物理性质如下表:
| 分子式 |
颜色、状态 |
水溶性 |
熔点/℃ |
密度/g·cm—3 |
|
| 草酸晶体 |
H2C2O4·2H2O |
无色晶体 |
易溶于水 |
101.5 |
1.650 |
有同学认为,用该装置进行实验,存在着不合理因素,请分析指出(任答两点):
①
②
Ⅱ.下图甲是 “铜丝在氯气中燃烧”的演示实验,铜丝在氯气中燃烧的主要现象是。有人对该实验提出了如下改进方案:
①按下图乙所示连接好装置,并检查气密性;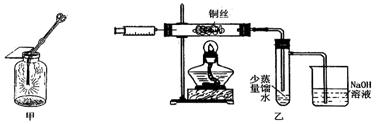
②取下注射器并集满Cl2;
③点燃酒精灯加热1~2min后,再移开酒精灯。迅速将注射针插入石英玻璃管内,并将Cl2缓缓推入玻璃管中;
④拔出针头,再用同样方法快速向玻璃管中推入空气。请回答:
(1)步骤③中,移开酒精灯、推入Cl2时,观察到铜丝继续保持红热状态,由此可判断,该反应为反应(填“放热”或“吸热”)。 (2)步骤④完成后,发现乙试管中的蒸馏水变为蓝绿色。此时缓缓拉动活塞,使少量NaOH溶液吸入乙试管中,看到试管中有色的沉淀产生,该反应的离方程式为。
(2)步骤④完成后,发现乙试管中的蒸馏水变为蓝绿色。此时缓缓拉动活塞,使少量NaOH溶液吸入乙试管中,看到试管中有色的沉淀产生,该反应的离方程式为。
(3)改进后的实验与课本实验相比较,其优点为
______________。
某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去)。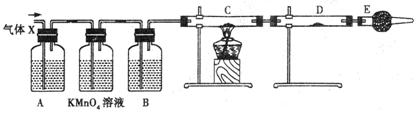
试回答:
(1)上述实验中生成二氧化硫的反应的化学方程式为:
(2)乙同学认为还可能产生氢气的理由:
。
(3)丙同学在安装好装置后,必不可少的一步操作是:。
(4)A中加入的试剂可能是____________,作用是_;
B中加入的试剂可能是____________,作用是;
E中加入的试剂可能是____________,作用是。
(5)可以证明气体X中含有氢气的实验现象是:
C中:,D中:;
如果去掉装置B,还能否根据D中的现象判断气体X中有氢气?____________
(填“能”或“不能”);其原因是:。
在密闭容器中投入一定量的A和B发生反应:mA(g)+nB(g) 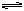 pC(g)。
pC(g)。
(1)欲使A与B的转化率等于m:n ,则起始加入A、B的物质的量之比为
(2)充入一定量的A、B,若在不同条件下C的体积分数随时间的变化如图1—1所示,则: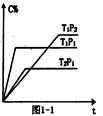
m+np(填“>”、“<”或“=”),
T1 T2填(“>”、“<”或“=”),
该反应的△H0(“>”、“<”或“=”)。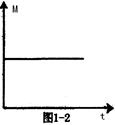
(3)一定条件下,从正反应开始达到化学平衡过程中,混和气体的平均相对分子质量随时间的变化如图1—2所示。若在恒温恒容的条件下,向原平衡体系中再通入一定量的C,则体系中气体的平均相对分子质量将(填“增大”、“减小”、“不变”或“无法确定”)
下表是元素周期表的前三周期:
| ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
| 一 |
A |
|||||||
| 二 |
B |
C |
D |
E |
F |
|||
| 三 |
G |
H |
I |
J |
回答下列问题:
⑴ 写出下列元素的元素的符号:F__________、J__________。
⑵ G元素与E元素形成的化合物的化学式是____________、____________,它们都是______________(填“离子”或“共价”)化合物。
⑶ 表格中十种元素的最高氧化物对应的水化物中,酸性最强的是____________,属于两性氢氧化物的是______________(用化合物的化学式表示)。
⑷ 只含有A、C两种元素的化合物称为____________,这些化合物中:
① 相对分子质量最小的是____________,该化合物的分子空间构型是_____________;
② 分子中含有双键,但原子数最少的是_____________,其电子式是__________________,它与HCl反应的化学方程式为____________________________________________________;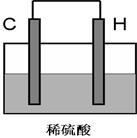
⑸ 将H单质与C的一种单质(导体)按如右图装置连接,
该装置名称为_____________。
其中C极为______________,
在该处能观察的现象是______________________________,
该电极反应式为:__________________________________。
请在右图上标出电子流动方向。
短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):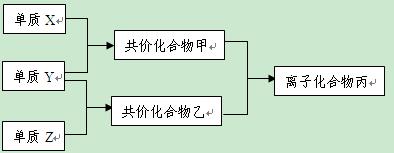
已知: a.常见双原子单质分子中,X分子含共价键最多。
b.甲分子中含10个电子,乙分子含有18个电子。
⑴ X的电子式是。
⑵ 实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲。
①在图中方框内绘出用烧瓶收集甲的仪器装置简图。
②试管中的试剂是(填写化学式)。
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)
。
⑶ 磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,丁的化学式是。
⑷ n mol丁与n mol丙在一定条件下反应,生成4n mol乙和另一化合物,该化合物蒸气的密度是相同状况下氢气的174倍,其化学式是。