硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫含量,采用以下方案:
甲方案:如下图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定二氧化硫的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A,根据碘水用量可计算SO2的量,与气体流量计数据之比即可判断SO2是否超标。
(1)已知二氧化硫与碘水的反应为: SO2+ I2+ H2O== H2SO4+ HI,配平该反应并指出还原剂 。
I2+ H2O== H2SO4+ HI,配平该反应并指出还原剂 。
(2)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验准确度,其理由是: 。
(3)洗气瓶C溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量
(填“偏高”、“偏低”或“无影响”)。
乙方案:尾气被过氧化氢氧化后与氢氧化钡反应,实验步骤如以下流程图所示:
(4)写出步骤①中反应的化学方程式 。
(5)写出步骤②中反应的化学方程式  。
。
(6)通过的尾气体积为VL(已换算成标准状况)时,该尾气中二氧化硫含量(体积分数)为 (用含有V、m的代数式表示)。
(7)若将乙方案中步骤①省略,直接将尾气通入过量Ba(OH)2溶液,其余步骤与方案乙相同,你认为这样处理是否合理 ,说明理由: 。
根据如图及描述,回答有关问题:
(1)关闭图A装置中的止水夹a后,从长颈漏斗向试管中注入一定量的水,静置后如图所示。试判断:A装置是否漏气?__________(填“漏气”“不漏气”或“无法确定”),做出该判断的理由是____________________。
(2)关闭图B装置中的止水夹a后,开启活塞b,水不断往下滴,直至全部流入烧瓶。试判断B装置是否漏气?__________(填“漏气”“不漏气”或“无法确定”),做出该判断的理由是____________________。
某固体可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该固体做如下实验,所得现象和有关数据如下图所示(气体体积的数据均已换算成标准状况下的体积):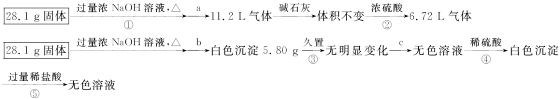
回答下列问题:
(1)混合物中是否存在FeCl2? __________(填“是”或“否”)。
(2)混合物中是否存在(NH4)2SO4?__________(填“是”或“否”);你的判断依据是______________________________。
(3)写出反应④的离子方程式______________________________。
(4)请根据计算结果判断混合物中是否存在AlCl3(说出你的判断依据,但不必写计算过程)______________________________。
金矿开采、冶炼和电镀工业会产生大量含氰化合物的污水,其中含氰化合物以HCN、CN-和金属离子的配离子 的形式存在于水中。测定污水中含氰化合物含量的实验步骤如下:
的形式存在于水中。测定污水中含氰化合物含量的实验步骤如下:
①水样预处理:水样中加入磷酸和EDTA,在pH<2的条件下加热蒸馏,蒸出所有的HCN,并用NaOH溶液吸收。
②滴定:将吸收液调节至pH>11,以试银灵作指示剂,用AgNO3标准溶液滴定Ag++2CN-====[Ag(CN)2]-,终点时,溶液由黄色变成橙红色。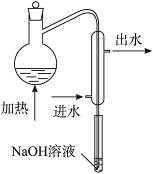
根据以上知识回答下列问题:
(1)水样预处理的目的是________________________________________。
(2)水样预处理的装置如图,细导管插入吸收液中是为了____________________。
(3)蒸馏瓶比吸收液面要高出很多,其目的是______________________________。
(4)如果用盐酸代替磷酸进行预处理,实验结果将__________(填“偏高”“无影响”或“偏低”)。
(5)准确移取某工厂污水100 mL,经处理后用浓度为0.010 00 mol·L-1的硝酸银标准溶液滴定,终点时消耗了21.00 mL。此水样中含氰化合物的含量为__________ mg·L-1(以CN-计,计算结果保留一位小数)。
)有一包白色粉末,其中可能含有Ba(NO3)2、CaCl2、K2CO3,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成。
②向①的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生。
③取少量②的溶液滴入稀硫酸,有白色沉淀生成。
④另取少量②的溶液滴入AgNO3溶液,有白色沉淀生成。
(1)根据上述实验现象,判断原白色粉末的组成成分是(写名称)__________。
(2)写出实验步骤①和④中有关化学反应的方程式:______________________________。
下面是实验室制取少量固体氧化铜的实验,根据实验步骤,回答有关问题。
(1)调整天平零点时,若指针偏向左边,应将右边的螺丝帽__________(填“向左”或“向右”)旋动。
(2)溶解样品时要用到玻璃棒,其作用是______________________________。
(3)反应生成沉淀的离子方程式为______________________________。
(4)加热蒸发过程中要用到玻璃棒,其作用是______________________________。
(5)过滤中要用到玻璃棒,其作用是______________________________。
(6)洗涤沉淀的目的是__________________________________________________________;
洗涤沉淀的方法是_______________________________________________________________;
为了检验沉淀是否洗涤干净,应在最后一次的洗涤液中加入__________溶液。
(7)最后一步操作中也要用到玻璃棒,其作用是______________________________。