某校化学实验兴趣小组为“证明某水煤气中CO2、CO 、H2 H2O(气)共同存在”。经讨论从以下提供的仪器和药品中设计组合成一套装置(假设其它杂质气体对本实验无干
扰)
(1)该小组证明CO2存在应选用_▲_装置,现象是:_▲_。证明H2O气的存在应选用_▲_装置,现象是:_▲_。
(2)若某些仪器可重复使用,某些仪器可不使用,B中反应完全进行,连接的玻璃导管、胶管忽略。按气流从左到右,用上述字母把各装置连接组合起来,正确的连接次序是:混合气体—( )—( )—( B )—( )—( )—( )
(3)此实验的操作步骤中还有一欠缺之处,应如何改进?_▲_。
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。
Ⅰ、测定过氧化氢的含量
请填写下列空白:
(1)移取10.00 mL密度为ρ g/mL的过氧化氢溶液至250mL ___________(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。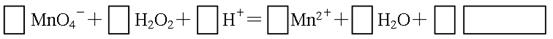
(3)滴定时,将高锰酸钾标准溶液注入(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为 。
。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果
(填“偏高”或“偏低”或“不变”)。
Ⅱ.探究过氧化氢的性质
该化学兴趣小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
请将他们的实验方法和实验现象填入下表:
| 实验内容 |
实验方法 |
实验现象 |
| 验证氧化性 |
||
| 验证不稳定性 |
某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为沉淀可能是CuCO3;
乙同学认为沉淀可能是Cu(OH)2;
丙同学认为沉淀可能是CuCO3和Cu(OH)2的混合物。(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ.按照甲同学的观点,发生反应的离子反应方程式为;
在探究沉淀成分前,须将沉淀从溶液中分离并净化。其具体操作依次为。
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。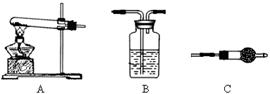
(1)各装置连接顺序为。
(2)能证明生成物中有CuCO3的实验现象是。
Ⅲ.若CuCO3和Cu(OH)2两者都有,可利用下列装置通过实验测定其组成。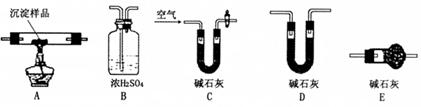
(1)装置C中碱石灰的作用是,实验开始和结束时都要通入过量的空气,请说明结束时通入过量空气的作用是
(2)若沉淀样品的质量为m克, 装置B质量增加了n克,则沉
装置B质量增加了n克,则沉 淀中CuCO3的质量分数为。
淀中CuCO3的质量分数为。
配制500mL 0.5mol·L-1的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为。
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现指针在分度盘的偏右位置,此时左边的托盘将(填“高于”或“低于”)右边的托盘。
(3)配制方法:设计五个操作步骤:
①向盛有NaOH的烧杯中加入200mL蒸馏水使其溶解,并冷却至室温。
②继续往容量瓶中加蒸馏水至液面接近刻度线1cm~2cm。
③将NaOH溶液沿玻璃棒注入500mL容量瓶中。
④在烧杯中加入少量的蒸馏水,小心洗涤2~3次后移入容量瓶。
⑤改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
试将以上顺序编出正 确程序。
确程序。
(4)某学生实际配制NaOH溶液的浓度为0.48mol·L-1,不可能的原因是
| A.使用滤纸称量氢氧化钠固体 |
B.容量瓶中原来存有少量蒸 馏水 馏水 |
| C.转移溶液后的烧杯未经多次洗涤 |
| D.胶头滴管加水后定容时仰视刻度 |
已知某混合金属粉末,除铝处还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计合理实验探究该混合物金属粉末中铁、铜元素的存在。
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1mol/L硫酸、2mol/L硝酸、2mol/LNaOH溶液、20%KSCN溶液。
完成以下实验探究过程:(1)提出假设:
假设1:该混合金属粉末中除铝外还含有元素;
假设2:该混合金属粉末中除铝外还含有元素;
假设3:该混合金属粉末中除铝外还含有Fe、Cu元素;
(2)设计实验方案基于假设3,设计出实验方案。(3)实验过程
根据(2)的实验方案,叙述实验操作、预期现象和结论。
| 编号 |
实验操作 |
预期现象和结论 |
| ① |
||
| ② |
||
| ③ |
||
| ④ |
||
某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。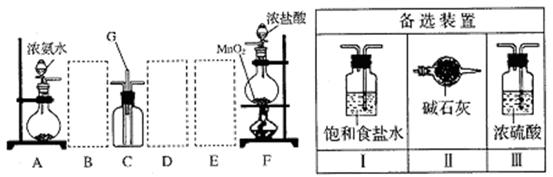
请回答下列问题:
(1)装置F中发生反应的离子方程式是。
(2)装置A中的烧瓶内固体可选用(选填以下选项的代号)。
A.碱石灰 B.浓硫酸 C.生石灰 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从右图的备选装置中选择,并将编号填入下列空格。B、D、E。
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为:;装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体就是氯化铵:。
(5)若从装置C的G处逸出的尾气中含有N2和少量C12,应如何处理?
。