配制500mL 0.5mol·L-1的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为 。
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现指针在分度盘的偏右位置,此时左边的托盘将 (填“高于”或“低于”)右边的托盘。
(3)配制方法:设计五个操作步骤:
①向盛有NaOH的烧杯中加入200mL蒸馏水使其溶解,并冷却至室温。
②继续往容量瓶中加蒸馏水至液面接近刻度线1cm~2cm。
③将NaOH溶液沿玻璃棒注入500mL容量瓶中。
④在烧杯中加入少量的蒸馏水,小心洗涤2~3次后移入容量瓶。
⑤改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
试将以上顺序编出正 确程序 。
确程序 。
(4)某学生实际配制NaOH溶液的浓度为0.48mol·L-1,不可能的原因是
| A.使用滤纸称量氢氧化钠固体 |
B.容量瓶中原来存有少量蒸 馏水 馏水 |
| C.转移溶液后的烧杯未经多次洗涤 |
| D.胶头滴管加水后定容时仰视刻度 |
实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是___________(填序号),配制上述溶液还需用到的玻璃仪器是_____ (填仪器名称)。
(2)在配制NaOH溶液时:
①根据计算用托盘天平称取NaOH的质量为________g;
②若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度_____(填“>”、“<”或“=”)0.1 mol/L;
③若NaOH固体溶解后立即移入容量瓶→洗烧杯→洗涤液移入容量瓶→定容,则所得溶液浓度________(填“>”、“<”或“=”)0.1 mol·L-1。
(3)在配制硫酸溶液时:
①所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________(计算结果保留一位小数)mL;
②如果实验室有15 mL、20 mL、50 mL量筒,应选用________mL量筒最好;
③配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是__________________。
下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务。
I.课本介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。注意闻生成物的气味,并观察铜丝表面的变化。
(1)小赵同学用化学方法替代“闻生成物的气味”来说明生成物的出现,该化学方法中所另加的试剂及出现的主要现象是 (用所学的知识回答)。
(2)小赵同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入足量的乙醛溶液,可以看到溴水褪色。该同学为解释上述现象,提出三种猜想:
①溴与乙醛发生取代反应;
② ;
③由于醛基具有还原性,溴将乙醛氧化为乙酸。
为探究哪种猜想正确,小李同学提出了如下两种实验方案:
方案一:用pH试纸检测溴水褪色后溶液的酸碱性;
方案二:测定反应前溴水中Br2的物质的量和反应后溶液中Br— 的物质的量。
(3)方案一是否可行 (填“是”或“否”),理由是 。
(4)小李同学认为:假设测得反应前溴水中Br2的物质的量为amol,若测得反应后n(Br— )= mol,则说明溴与乙醛发生取代反应。
(5)小吴同学设计如下实验方案:
①按物质的量之比为1:5配制KBrO3—KBr溶液,加合适的适量的酸,完全反应并稀至1L,生成0.5molBr2。
②取上述溶液10mL加入足量乙醛溶液,使之褪色,然后将所得溶液稀释为100mL,准确量取其中10mL。
③加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到淡黄色固体0.188g。
试通过计算判断:溴与乙醛发生反应的化学方程式为 。
Ⅱ.小刘同学在查阅资料时得知,乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:
| 物质 |
乙醛 |
乙酸 |
甘油 |
乙二醇 |
水 |
| 沸点 |
20.8℃ |
117.9℃ |
290℃ |
197.2℃ |
100℃ |

请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件) 。
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在 ;目的是 ;当试管A内的主要反应完成后温度计水银球的位置应在 ,目的是 。
(3)烧杯B内盛装的液体可以是 (写出一种即可,在题给物质中找)。
氨与硝酸都是氮的重要化合物,在工农业生产中有广泛应用。完成下列填空:
实验室设计了如图所示的实验装置,进行“氨的催化氧化”等实验。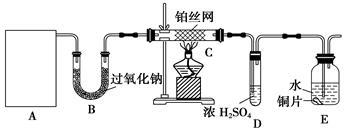
(1)A处是气体发生装置,A中所用试剂只能从下列物质中选取:
①硝酸铵 ②碳酸氢铵 ③氯化铵 ④熟石灰 ⑤氢氧化钠
若A中制取气体时只用了一种试剂,该试剂可以是____________(选填上述编号),此时A处的装置应为______________(选填下列编号)。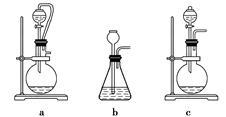
至此,完成了对图1中装置的补充。某同学从安全与环保的角度考虑,该装置存在两处明显的缺陷,你认为这两处缺陷是______________、_________________。
(2)写出图1装置B中发生反应的化学方程式(写一个即可) ;
在图1中,若A、B处试剂足量,则装置E中发生反应的离子方程式为:____________________。
(3)写出图1装置C中发生反应的化学方程式________________。
单晶硅是信息产业中重要的基础材料。通常用炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
相关信息:①四氯化硅遇水极易水解;②SiCl4沸点为57.7℃,熔点为-70.0℃。请回答:
(1)写出装置A中发生反应的离子方程式 。
(2)装置C中的试剂是 ;装置F的作用是 ;
装置E中的h瓶需要冷却的理由是 。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中含有铁元素,为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定。
①反应的离子方程式: 。
②滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。
③滴定前检验Fe3+是否被完全还原的实验操作是 。
(9分)某研究性学习小组在网上收集到信息:钠、镁等活泼金属都能在CO2气体中燃烧。
他们对钠在CO2气体中燃烧后得到的白色产物进行了如下探究:
[实验操作] 将燃烧的钠迅速伸入装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底有黑色颗粒,瓶壁上附着白色物质。
[提出假设]
假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物。
[设计方案] 该小组对燃烧后生成的白色物质进行如下探究:
| 实验方案 |
实验操作 |
实验现象 |
结论 |
| 方案1 |
取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 |
溶液变成红色 |
白色物质为Na2O |
| 方案2 |
①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液。 ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 |
①出现白色沉淀。 ②无明显现象 |
白色物质为Na2CO3 |
请回答下列问题:
(1)写出金属镁与二氧化碳反应的化学方程式:__________________。
(2)甲同学认为方案1得到的结论不正确,其理由是________________。
(3)钠在二氧化碳中燃烧的化学方程式为________________。
(4)乙同学认为白色物质有可能是氢氧化钠。你是否同意乙同学的观点,并简述理由:___________。