化学上常用燃烧法确定有机物的组成。下图装置是用燃烧法确定有机物化学式常用的装置,这种方法是在电炉加热时用纯氧氧化管内样品。根据产物的质量确定有机物的组成。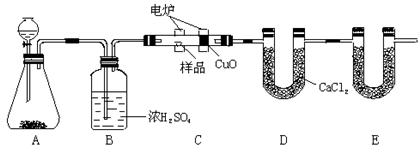
回答下列问题:
(1)A装置中分液漏斗盛放的物质是 ,写出有关反应的化学方程式: 。
(2)C装置(燃烧管)中CuO的作用是 。
(3)写出E装置中所盛放物质的名称 ,它的作用是 。
(4)若准确称取1.20g样品(只含C、H、O三种元素中的两种或三种)。经充分燃烧后,E管质量增加1.76g,D管质量增加0.72g,则该有机物的最简式为 。
可利用下图中的实验装置测定足量铜与适量一定浓度的浓硝酸反应生成的NO气体和NO2气体的物质的量之比(用m表示),其中装置C由广口瓶和量气管组成,量气管由甲、乙两根玻璃管组成,用橡皮管连通,并装入适量水,甲管有刻度(0mL~50mL),乙管可上下移动。


A BC
回答下列问题:
(1)实验中气体(NO和NO2)发生装置应选择(填装置序号)。
(2)实验中的气体(NO和NO2)通入C装置,请在下图的广口瓶中将导气管画出。
(3)要测定m值,需要将C中的溶液进行中和滴定,由于浓硝酸具有强氧化性,能把酸碱指示剂氧化褪色而影响实验。因此,中和滴定前必须进行的操作是。
(4)连接好装置,检查气密性后,应进行两步必要的操作:
第一,打开b,向C装置的乙管中加适量水;
第二。
(5)实验前甲、乙两管液面在同一水平面上,最后读数时乙管的液面高于甲管的液面。此时应进行的操作是。
(6)实验后若量气管中气体的体积(换算成标准状况下)为V(L),C中硝酸的物质的量为nmol,则用含n和V的式子表示m=(结果可不必化简)。
某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素碳与硅的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红色试纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。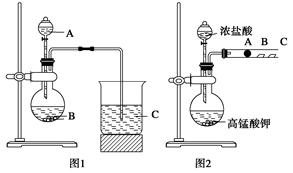
根据图1回答:
(1)写出选用物质的名称:A____________,B__________,C____________;
(2)烧瓶中反应的离子方程式为_______________________________________________
烧杯中反应的离子方程式为_______________________________________________。
根据图2回答:
(3)乙同学的实验原理是_______________________________________________
(4)B处的实验现象是_______________________________________________;
(5)B处的反应的离子方程式: ____________________________________________。
通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的的质量确定有机物的组成。下图所示的是用燃烧法确定有机物物分子式的常用装置。
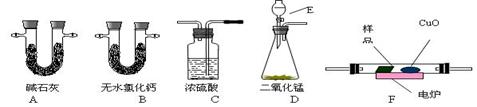
回答下列问题:
(1)现准现准确称取0.44 g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重0.88 g,B管增重0.36g。请回答:(1)按上述所给的测量信息,装置的连接顺序应是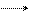


 DF;
DF;
(2)A、B管内均盛有有固态试剂,A管的作用是______________________; (3)E中应盛装什么试剂:_______________;
(3)E中应盛装什么试剂:_______________;
(4)如果把CuO网去掉,A管重量将_______;(填“增大”、“减小”、或“不变”)
(5)请改进这套装置的一个不足之处;;
(6)该有 机物的实验式为__________________;
机物的实验式为__________________;
(7)要确定该有机物的分子式,还必须知道的数据是__ _________。
_________。
(7分) DIS系统即数字化信息系统,它由传感器、数据采集器和计算机组成,某学习小组用DIS系统测定食用白醋中醋酸的物质的量浓度,以溶液的导电能力来判断滴定终点。实验步骤如下:
(1) 用_________________(填仪器名称)量取10. 00mL的食用白醋,在烧杯中用水稀释后转移到100mL________(填仪器名称)中定容,然后将稀释后的溶液倒人试剂瓶中。
(2)量取20. 00 mL的上述溶液倒入烧杯中,连接好DIS 系统(如上图),向烧杯中滴加浓度为0.1000mol·L -1的氨水,计算机屏幕上显示出溶液导电能力随
氨水体积变化的曲线(见图)。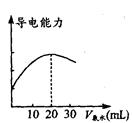
①用滴定管盛氨水前,滴定管要用__________润洗2~3遍
②氨水与醋酸反应的离子方程式是___________________。
③食用白醋中醋酸的物质的量浓度是__________________。
某化学课外活动小组设计实验探究氮的化合物的性质,装置如下图 所示(A装置未画出),其中A为气体发生装置。A中所用试剂,从下列固体物质中选取:
所示(A装置未画出),其中A为气体发生装置。A中所用试剂,从下列固体物质中选取:
a. NH4HCO3 b. NH4Cl c. Ca(OH)2d. NaOH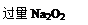
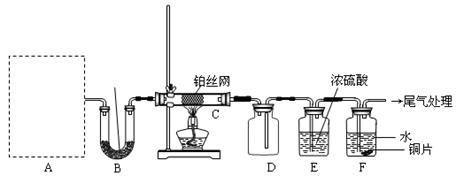
检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯。部分实验现象如下:铂丝继续保持红热,F处铜片逐渐溶解。
(1)实验室制取A中气体时若只用一种试剂,该试剂是(填代表备选试剂的字母);此时A中主要的玻璃仪器有(填名称)。
(2)A中产生的物质被B中Na2O2充分吸收,写出任意一个B中发生反应的化学方程式: 。
。
(3)对于C中发生的可逆反应,下列说法正确的。
a. 增大一种反应物的浓度可以提高另一种反应物的转化率
b. 工业上进行该反应时,可采取高压的条件提高反应物转化率
c. 该反应在一定条件下达到平衡时,反应物的平衡浓度之比一定是4:5
d. 使用铂丝网可以使正反应速率增大,同时也增大逆反应速率
(4)请在图坐标中画出C装置中反应发生过程中的能量变化示意图(具 体能量数值不用
体能量数值不用 标出),并在虚线上分别标出反应物和生成物的化学式。
标出),并在虚线上分别标出反应物和生成物的化学式。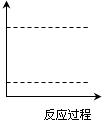
(5)待实验结束后,将B中固体混合物溶于500 mL 1 mol·L-1的盐酸中,产生无色混合气体甲,溶液呈中性,则实验前B中原有Na2O2的物质的量是mol,甲在标准状况下体积为L(忽略气体溶解)。