某有机物的结构简式为HOOC—CH=CHCH2OH
(1)该有机物在一点条件下既能发生加聚反应又能发生缩聚反应,请分别写出产物的结构简式_______________; 。
(2)验证该有机物中含有—COOH常采用的试剂是 ,产生的现象为 。
(3)请从下列试剂中选择适当试剂,检验该有机物分子中含有醇羟基,并写出实验方法和现象
备选试剂:①钠②NaOH溶液③溴水④酸性KMnO4溶液 ⑤新制Cu(OH)2悬浊液
(1) 在NaNO3中N的化合价是___价;在NH4Cl中N的化合价是___价。
(2)请根据物质的“俗称”写出相应的化学式
大理石__________、纯碱__________、烧碱_________、铜绿__________、胆矾__________、
(3) 请根据物质名称写出相应的化学式
硝酸_________、碳酸氢钙________、高锰酸钾________、 硫酸钡________、硫酸铝_______、
(4) A、B、C、D四个试剂瓶中分别盛碳酸钠、硝酸银、烧碱、稀硫酸四种稀溶液中的一种,取四种溶液各少量,依次滴入物质X的溶液和稀硝酸,发生的现象如下表所示:
| A |
B |
C |
D |
|
| X |
白色沉淀 |
白色沉淀 |
白色沉淀 |
无现象 |
| 稀硝酸 |
沉淀不消失 |
沉淀消失 有气体产生 |
沉淀不消失 |
无现象 |
回答:
①物质X的化学式是_________。
②物质B是_______________,加入X后反应的化学方程式是__________________,加稀硝酸后,沉淀消失的反应化学方程式是___________________________。
③为进一步区别A和C,可根据置换反应的原理进行实验,写出其中一个反应的化学方程式___________________________。
以下是日常生活中常见的一些物质:①液氧、②氢气、③水、④空气、⑤二氧化碳、
⑥氯酸钾、⑦水泥、⑧石油、⑨水银、⑩碱式碳酸铜、⑾纯净的矿泉水,请你指出(填序号):
(1)属于金属单质的是,属于非金属单质的是。
(2)属于化合物的是,含有元素种类最多的化合物是。
(3)属于混合物的是。
煤化工中常需研究不同温度下平衡常数、投料比及热值等问题
已知:CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度变化如下表:
H2(g)+CO2(g)的平衡常数随温度变化如下表:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数Kc |
9.94 |
9 |
1 |
试回答下列问题
(1)上述逆反应是: 反应(选填:“放热”、“吸热”)。
(2)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有 (选填A、B、C、D、E)。
| A |
B |
C |
D |
E |
|
| n(CO2) |
3 |
1 |
0 |
1 |
1 |
| n(H2) |
2 |
1 |
0 |
1 |
2 |
| n(CO) |
1 |
2 |
3 |
0.5 |
3 |
| n(H2O) |
5 |
2 |
3 |
2 |
1 |
(3)已知在一定温度下:C(s)+CO2(g)  2CO(g)平衡常数K;
2CO(g)平衡常数K;
C(s) + H2O(g)  CO(g)+H2(g)平衡常数K1;
CO(g)+H2(g)平衡常数K1;
CO(g)+H2O(g) H2(g)+CO2(g) 平衡常数K2 。
H2(g)+CO2(g) 平衡常数K2 。
则K、K1、K2之间的关系是: 
(4)在VL密闭容器中通入10molCO和10mol水蒸气,在T℃达到平衡,然后急速除去水蒸气(除水蒸气时各物质的物质的量不变),将混合气体燃烧,测得放出的热量为2842kJ(已知CO燃烧热为283kJ/mol,H2燃烧热为286kJ/mol),则T℃平衡常数K= 。
降低大气中CO2的含量及有效利用CO2,目前已引起各国普遍重视。
(1)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应式为。
(2)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,在500℃下发生反应:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g) 。
CH3OH(g)+H2O(g) 。
实验测得CO2(g)和CH3OH(g)的浓度随时间变化如下图1所示。
①图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反应
是(填“吸热”或“放热”)反应。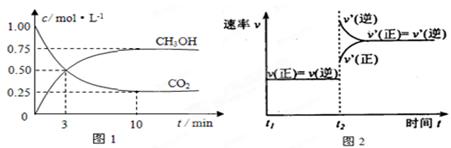
②500℃达平衡时,CH3OH的体积分数为。
(1)将反应2H2(g)+O2(g)=2H2O(1) △H<0,以KOH溶液为电解质溶液,设计一个原电池,其负极反应为:。
(2)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与下图中电解池相连,其中,a为电解液,X和Y是两块电极板,则: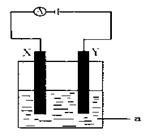
①若X和Y均为惰性电极,a为CuSO4溶液,则电解时的化学反应方程式为:。
通过一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为。
②若X、Y分别为铁和铜,a仍为CuSO4溶液,则Y极的电极反应式为。