根据所学知识,完成下列要求。
(1)Fe2(SO4)3(写出电离方程式): 。
(2)H++OH-═ H2O(写出对应的化学方程式): 。
(3)氧化铜溶于盐酸(写出对应的离子反应方程式): 。
(4)锌与稀硫酸反应制取氢气(写出对应的离子反应方程式): 。
下图中A~J分别代表相关反应的一种物质。已知A分解得到等物质的量的B、C、D,图中有部分生成物未标出。
请填写以下空白:
(1)A的化学式。
(2)定出反应①②的化学方程式:
①,
②。
(3)写出反应③的离子方程式:。
(4)J与F反应的化学方程式:。
(5)在反应④中,当生成标况下2.24 L G时,转移电子数为mol。
工业上可用铜屑和浓硝酸为原料制取硝酸铜。在实际生产中,先把铜屑在空气中灼烧,再跟用等体积水稀释的浓硝酸反应来制取硝酸铜。请回答下列问题:
(1)不宜于用铜屑直接与硝酸反应来制取硝酸铜的原因是。
(2)浓硝酸用等体积水稀释的目的是。
(3)要得到硝酸铜晶体,应选用。
(4)反应中硝酸表现出性。
X、Y、Z、W四种化合物均由短周期元素组成。其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。
请回答:
(1)W的电子式是。
(2)X与Y在溶液中反应的离子方程式是。
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种无色气体。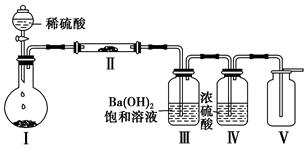
①装置Ⅰ中反应的化学方程式是,
装置Ⅱ中物质的化学式是。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置Ⅴ中气体,该化合物的化学式是,所需仪器装置是。
(从上图选择必要装置,填写编号)
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是。
已知A~I均为中学化学中的常见物质,它们之间的转化关系如图所示,其中A、D为金属单质,反应过程中需要或生成的水及其他部分产物已略去。请回答以下问题:
(1)B和F分别是(填化学式)。
(2)写出下列反应的化学方程式:
①A与B在高温下反应:。
②H在空气中转变为I:。
(3)E溶液中所有离子浓度由大到小的顺序是。
(4)用离子反应方程式表示G溶液呈酸性的原因;该反应的平衡常数为(已知常温下,H的溶度积常数Ksp=8.0×10-16)。
铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题。
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后溶液中大量存在的阳离子是;Y与过量浓硝酸反应后溶液中含有的盐的化学式为。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧,并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是。
A.Mg2+B.Fe2+C.Al3+D.Cu2+
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下: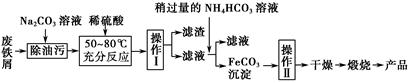
回答下列问题:
①操作Ⅰ的名称是;操作Ⅱ的名称是;操作Ⅱ的方法为。
②请写出生成FeCO3沉淀的离子方程式: 。