(一)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)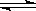 4NO2(g)+O2(g);ΔH>0
4NO2(g)+O2(g);ΔH>0
①反应达平衡后,若再通入一定量氮气,则N2O5的转化率将 。(填“增大”或“减小”、“不变”)
②下表为反应在T1温度下的部分实验数据:
| t/s |
0 |
500 |
1000 |
| c(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.48 |
则500s内N2O5的分解速率为 。
③在T2温度下,反应1 000 s时测得NO2的浓度为4.98 mol·L-1,则T2 T1。
(二)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ∆H < 0 (I)
NaNO3(s)+ClNO(g) K1 ∆H < 0 (I)
2NO(g)+Cl2(g) 2ClNO(g) K2 ∆H < 0 (II)
2ClNO(g) K2 ∆H < 0 (II)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)=
mol,NO的转化率а1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”。
(三)已知C(s)+H2O(g)=CO(g)+H2(g)ΔH=akJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-220kJ·mol-1
H-H、O=O和O-H键的键能分别为436、496和462kJ·mol-1,则a为
(10分)通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的反应热(△H)。
| 化学键 |
Cl-Cl |
H—H |
H—Cl |
N≡N |
| 键能/kJ·mol |
243 |
436 |
431 |
946 |
(1)按要求完成填空
a 2HCl(g) = H2(g)+Cl2(g);△H=
bN2 (g)+3H2(g)= 2NH3(g) ΔH="-92" kJ/mol,则N—H键的键能是kJ·mol
(2)1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式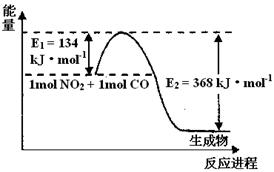
(3)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g)ΔH1
② 2CO (g)+ O2(g) = 2CO2(g)ΔH2
③ H2O(g) = H2O(l)ΔH3
则CH3OH(l)+O2(g)=" CO(g)" + 2H2O(l)ΔH=(用含ΔH1、ΔH2、ΔH3的式子表示)
(4)已知:2Al (s)+ 3/2O2(g)==Al2O3(s)△H=" -1" 644.3 kJ• mol-1
2Fe (s) +3/2O2(g)==Fe2O3(s)△H=" -815.88" kJ• mol-1
试写出铝粉与氧化铁粉末发生铝热反应的热化学方程式_______________________。
相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。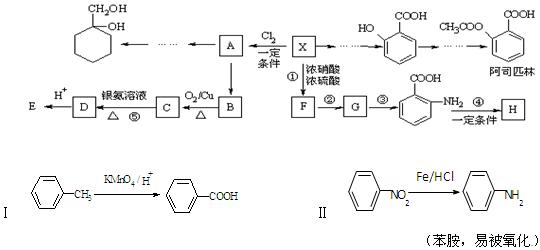
请根据所学知识与本题所给信息回答下列问题:
⑴ H的结构简式是;
⑵反应②、③的类型分别是,。
⑶反应⑤的化学方程式是;
⑷阿司匹林最多消耗mol NaOH;
⑸ 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有种;
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有种;
⑹请用合成反应流程图表示出由A和其他无机物合成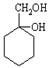 最合理的方案(不超过4步)。
最合理的方案(不超过4步)。
流程图示例: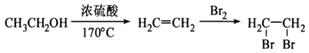
BGO是我国研制的一种闪烁晶体材料,曾用于诺贝尔奖获得者丁肇中的著名 实验,它是锗酸铋的简称。若知:①在BGO中,锗处于其最高价态。②在BGO中,铋的价态与铋跟氯形成某种共价氯化物时所呈的价态相同,在此氯化物中铋具有最外层8个电子稳定结构。③BGO可看成是由锗和铋两种元素的氧化物所形成的复杂氧化物,且在BGO晶体的化学式中,这两种氧化物所含氧的总质量相同。
实验,它是锗酸铋的简称。若知:①在BGO中,锗处于其最高价态。②在BGO中,铋的价态与铋跟氯形成某种共价氯化物时所呈的价态相同,在此氯化物中铋具有最外层8个电子稳定结构。③BGO可看成是由锗和铋两种元素的氧化物所形成的复杂氧化物,且在BGO晶体的化学式中,这两种氧化物所含氧的总质量相同。
请填空::
(1)锗在周期表中的位置
(2)BGO晶体的化学式是 _ _.
(3)铋的最高价氧化物的化学式是.____
(4)与锗同周期的其他元素的基态原子中,未成对电子数最多的元素是(填元素符号),该元素的基态原子电子排布式为
PC是一种可降解的聚碳酸酯类高分子材料,由于其具有优良的耐冲击性和韧性,因而得到了广泛的应用。以下是某研究小组开发的生产PC的合成路线: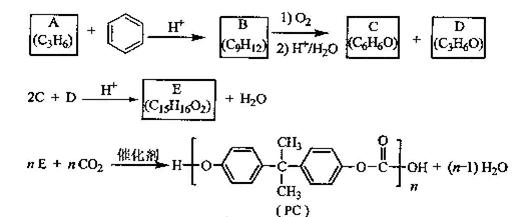
已知以下信息:
①A可使溴的CCl4溶液褪色;
②B中有五种不同化学环境的氢;
③C可与FeCl3溶液发生显色反应:
④D不能使溴的CCl4褪色,其核磁共振氢谱为单峰。请回答下列问题:
(1)A的化学名称是
(2)B的结构简式为
(3)D有多种同分异构体,其中能发生银镜反应的是简式
(4)C与D反应生成E的化学方程式为
(5)B的同分异构体中含有苯环的还有种,其中在核磁共振氢谱中出现两组峰,且峰
面积之比为3:1的是(写出结构简式)。
主族元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3倍。X、Y和Z分属不同的周期,他们的原子序数之和是W原子序数的5倍,Z元素的基态原子的最外层一个未成对电子,在由元素W、X、Y、Z组成的所有可能的二组分化合物中,由元素W与Y形成的化合物M的熔点最高。请回答下列问题:
(1)W元素与X元素相比,电负性X大于W,下列能证明这一事实的是(填选项序号)
| A.常温下X单质的颜色比W单质的颜色深 |
| B.X单质与W的氢化物剧烈反应,产生W的单质 |
| C.X与W形成的化合物中X元素呈负价态 |
| D.比较两元素的单质与氢气化合时得电子的数目 |
(2)化合物M的化学式为,其晶体结构与NaCl相同,而熔点高于NaCl。M熔点较高的原因是。将一定量的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂醇酯交换合成碳酸二月桂酯。在碳酸二甲酯分子中,碳原子采用的杂化方式有,O—C—O的键角约为;
(3)灼烧含元素Z的盐,会使火焰呈现特殊的颜色,请用原子结构的知识解析其原因:。