下列物质中,互为同位素的是 (填序号,下同),互为同素异形体的是 ,互为同系物的是 ,互为同分异构体的是 。
①金刚石; ②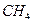 ; ③
; ③ ; ④
; ④ ;⑤
;⑤
⑥石墨; ⑦ ; ⑧
; ⑧
已知氯水中有如下平衡:Cl2+H2O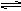 HCl+HclO。
HCl+HclO。
①常温下,在一个体积为50mL的针筒里吸入40mLCl2后,再吸进10mL水,写出针筒中可能观察到的现象是:。
②若将此针筒长时间放置,又可能看到变化为:。
试用平衡移动的观点加以解释:。
如图所示,温度不变的条件下,某容器分隔A、B两部分,A容器固定不变,B有可移动的活塞,现在A中充入2 molSO2和1 molO2,在B中充入2 molSO3和1molN2,在相同条件下发生可逆反应:2SO2(g)+O2(g) 2SO3(g),根据下列要求填写空白:
2SO3(g),根据下列要求填写空白:
⑴.固定活塞位置在3处不动,达到平衡后,设A中压强为PA,B中压强为PB,则PA与PB的压强是PAPB (填“<”、“>”、“=”)。
⑵.若要使A中与B中平衡状态相同,可移动活塞的位置应在处。
⑶.若活塞右移到5处,达到平衡后,B中SO3为xmol,A中SO3为y mol,则x和y的关(填“<”、“>”、“=”),理由是。
A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1mol/L。反应进行2min后A的浓度为0.8mol/L,B的浓度为0.6mol/L,C的浓度为0.6mol/L。则2min内反应的平均速率υA=__________,υB=_____________,υC=___________。该反应的化学反应方程式为 。
在一定条件下,1mol N2和3mol H2混合后充分反应,达到平衡时测得平衡混合物的密度是同温同压下氢气的5倍,则氮气的转化率为 。若在同一个容器中,在相同的温度下,向容器中充入NH3,为使达到平衡时各成分的百分含量与上述平衡时相同,则起始时充入的NH3的物质的量为 。
)在一定体积的密闭容器中,进行如下化学方程式:CO(g)+H2O(g) CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.5 |
回答下列问题:
⑴该反应化学平衡常数的表达式为K=。
⑵该反应为(填“放热”或“吸热”)反应。
⑶能判断该反应是否达到化学平衡状态的依据是。
| A.容器中压强不变 | B.混合气体中c(CO)不变 |
| C.υ(正,H2)=υ(逆,H2O) | D.c(CO2)=c(CO) |
⑷某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O)。试判断此时的温度为℃。