物质(t-BuNO)2在正庚烷溶剂中发生如下反应:(t-BuNO)2 2(t-BuNO) 。
2(t-BuNO) 。
(1)当(t-BuNO)2的起始浓度(c0)为0.50 mol·L-1时,实验测得20℃时的平衡转化率(α)是65 %。列式计算20℃时上述反应的平衡常数K = 。
(2)一定温度下,随着(t-BuNO)2的起始浓度增大,其平衡转化率 (填“增大”、“不变”或“减小”)。
(3)实验测得该反应的ΔH =" +" 50.5 kJ·mol-1,活化能Ea = 90.4 kJ·mol-1。下列能量关系图合理的是 。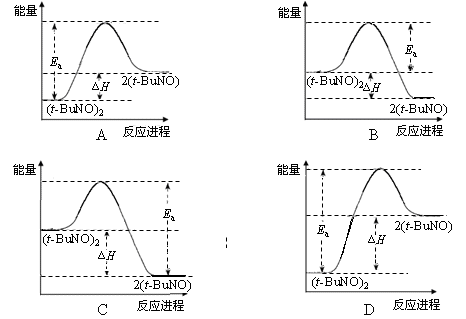
(4)结合ΔS推测该反应的在 (填“较高”或“较低”)温度下有利于该反应自发进行。
2014年8月3日16时30分在云南省昭通市鲁甸县(北纬27.1度,东经103.3度)发生6.5级地震,震源深度12千米,已致589人遇难。饮用水安全在灾后重建中占有极为重要的地位,某研究小组提取三处被污染的水源进行了如下分析:并给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E五种常见化合物都是由下表中的离子形成的:
| 阳离子 |
K+、Na+、Cu2+、Al3+ |
| 阴离子 |
SO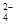 、HCO 、HCO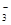 、NO 、NO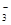 、OH- 、OH- |
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验现象填写下列空白:
(1)写出化学式:A________ 、B________、C ________ 、D________。
(2)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为________。
(3)写出实验②发生反应的离子方程式__________________、________________。
(4)C常用作净水剂,用离子方程式表示其净水原理_________________________。
下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去)。已知A、B为气态单质,F是地壳中含量最多的金属元素的单质,E、H、I为氧化物,E为黑色固体,I为红棕色气体,M为红褐色沉淀。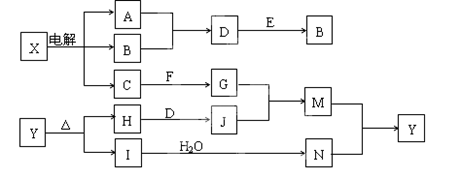
请回答下列问题:
(1)B中所含元素位于周期表中第 周期 族。
(2)A在B中燃烧的现象是 。
(3)D + E → B的反应中,被氧化与被还原的物质的量之比是 。
(4)G + J → M的离子方程式是 。
(5)试推测Y受热分解的化学方程式是 。
铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
(1)鉴别Fe(OH)3胶体和FeCl3溶液的方法是 。
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式: 。
(3)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈血红色,可知待测液中一定含有的金属阳离子是 ;
②验证该溶液中同时含有Fe2+,正确的实验方法是 。
A.观察溶液是否呈浅绿色
B.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.取适量溶液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(4)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案: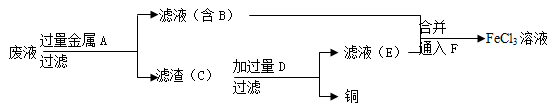
①滤渣C的化学式为 。
②加过量D发生反应的离子方程式为 。
③通入F发生反应的化学方程式为 。
(12分)煤、天然气是社会生产、生活中重要的能源。
(1)工业上常把煤进行气化和液化处理,使煤变成清洁能源.煤气化和液化流程示意图如下: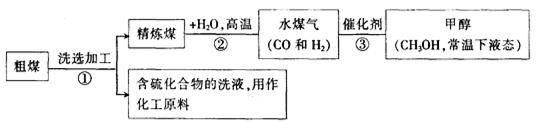
①已知H2、CO和CH3OH的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。写出由CO和H2合成甲醇的热化学方程式_________________
②煤进行气化和液化的优点是
(2) 天然气催化重整也可生成CO和H2
①500℃,向一体积可变的密闭容器中充入一定量CH4和水蒸气进行催化重整, 下列能说明反应一定处于平衡状态的是
| A.混合气体的密度不随时间变化 |
| B.CO和H2的体积分数之比不随时间变化 |
| C.v正(CH4)=3v逆(H2) |
| D.混合气体的平均相对分子质量不随时间变化 |
②CO和H2可用作燃料电池。一种熔融碳酸盐燃料电池原理示意如图: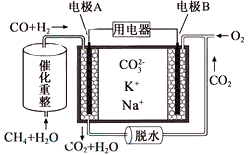
写出A电极反应式__________________
(3)CO一旦泄露会造成污染,环保检测中,有害气体的浓度常用1L有害气体的毫克值(mg/L)来表示,如对某气体样品中所含一氧化碳的浓度进行测定,其方法和实验步骤如下:
①首先将2.00L的气体样品通过盛有I2O5固体的加热管,反应后生成CO2和I2;
②用30.0mL 5.00×10-3mol/L的硫代硫酸钠溶液恰好吸收所产生的碘,发生的反应为:I2+2S2O32-=2I-+S4O62-
则样品中CO的浓度为
下图所示为一个有机合成反应的流程图:(已知:R-Cl在NaOH溶液中生成R-OH)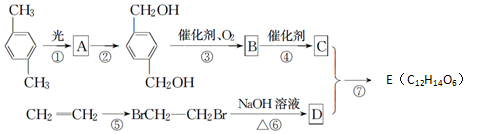
请根据图示回答下列问题:
(1)写出中间产物A、B、D的结构简式。
A_______________,B__________________D________________。
(2)在图中①至⑦的反应中属于取代反应的是________。(填序号)
(3)写出反应⑦的化学反应方程式
(4)写出C的同分异构体X,要求符合以下两个条件:
ⅰ.苯环上有两个侧链;
ⅱ.1molX与足量NaHCO3溶液反应产生1molCO2气体。
写出符合上述两条件的X的所有结构简式________。