下列说法中正确的是 ( )
| A.81Br原子的中子数比电子数多11 |
| B.金属原子的核外电子在金属晶体中都是自由电子 |
| C.NaCl和SiO2晶体溶化时,克服粒子间作用力的类型相同 |
| D.同周期的ⅠA族元素的金属性比ⅡA族元素的金属性强 |
某有机物的结构可如下图表示,下列有关该化合物的说法中正确的是:
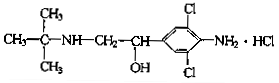
| A.属于属于芳香化合物 |
| B.它不能发生酯化反应 |
| C.不能发生氧化反应 |
| D.分子式为C12H19Cl3N2O |
亚麻油酸是淡黄色的透明液体,在医疗上可用于治疗高血脂和动脉硬化,其结构简式为CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH,下列说法中正确的是
| A.亚麻油酸是一种植物油 |
| B.等物质的量的两份亚麻油酸分别和Na、H2反应,消耗二者的物质的量之比为1∶1 |
| C.亚麻油酸可以发生氧化、加成、水解等反应 |
| D.亚麻油酸能使溴的CCl4溶液褪色 |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2 mol电子,参加反应的锌质量为6.5g |
关于如图所示装置的叙述,正确的是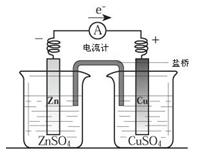
| A.铜是负极,铜片上有气泡产生 |
| B.锌片质量逐渐减少 |
| C.电流从锌片经导线流向铜片 |
| D.铜离子在铜片表面被还原 |
手性分子是指在分子结构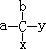 中,当a、b、x、y为彼此互不相同的原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子。下列分子中指定的碳原子(用*标记)不属于手性碳原子的是
中,当a、b、x、y为彼此互不相同的原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子。下列分子中指定的碳原子(用*标记)不属于手性碳原子的是
A.苹果酸 |
B.丙氨酸 |
C.葡萄糖 |
D.甘油醛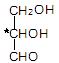 |