在室温下,0.1 mol·L-1 100ml的氨水中,欲使其溶液的pH减小,又要使氨水电离程度减小,应采取( )
| A.通入少量氯化氢气体 | B.加入少量水 |
| C.加入少量NaOH固体 | D.加入少量NH4Cl固体 |
元素R、T、X、Y、Z在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸,生成HR。则下列判断正确的是
| A.非金属性:Z<Y<X |
| B.R与Y的电子数相差8 |
| C.气态氢化物稳定性:HR<HY<HT |
| D.最高价氧化物的水化物的酸性:HTO4>HYO4 |
炼铁高炉中冶炼铁的反应为:Fe2O3(s) + 3CO(g)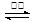 2Fe(s) +3CO2(g),下列说法正确的是
2Fe(s) +3CO2(g),下列说法正确的是
| A.升高温度,反应速率减慢 |
| B.当反应达到化学平衡时,υ(正)=υ(逆) = 0 |
| C.提高炼铁高炉的高度可减少尾气中CO的浓度 |
| D.某温度下达到平衡时,CO的体积分数基本不变 |
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z的二价阳离子与氖原子具有相同的核外电子排布,W与Y同主族,下列说法正确的是
| A.R的原子半径在五种原子中最大 |
| B.Y的氢化物的稳定性比W的强 |
| C.X与Y形成的化合物只有一种 |
| D.R的最高价氧化物的水化物的酸性比W的弱 |
下列各组比较,不正确的是
| A.酸性:HClO4>H2SO4>H3PO4 |
| B.稳定性:HBr>HCl >HF |
| C.原子半径:r(Si)>r(N)>r(O) |
| D.碱性:NaOH>Mg(OH)2>Al(OH)3 |
下列四支试管中,双氧水分解的化学反应速率最大的是
| 试管 |
温度 |
过氧化氢浓度 |
催化剂 |
| A |
室温(25℃) |
12% |
MnO2 |
| B |
室温(25℃) |
4% |
无 |
| C |
水浴加热(50℃) |
12% |
无 |
| D |
水浴加热(50℃) |
12% |
MnO2 |