二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
⑴煤的气化的主要化学反应方程式为:___________________________。
⑵煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:________________________________________。
⑶利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)  CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g) + H2O(g)  CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)  CH3OCH3(g) + CO2 (g) ΔH=-246.4kJ· mol -1;
CH3OCH3(g) + CO2 (g) ΔH=-246.4kJ· mol -1;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是_______(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
⑷已知反应②2CH3OH(g)  CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
①比较此时正、逆反应速率的大小:v正 ______ v逆(填“>”、“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率v(CH3OH) = __________。
A、B、C、D均为含苯环的化合物,且相对分子质量B>A>C,已知有机物A的分子式为C7H6O3,A分子中苯环上只有两个官能团,且苯环的一氯代物只有两种结构,A能与碳酸氢钠反应产生气体。
(1)A能与碳酸氢钠反应,写出该化学方程式:
________________________________________________________________________;少量A与下列试剂反应的反应类型、现象描述都正确的是________________。
| 试剂 |
反应类型 |
实验现象 |
|
| a |
浓溴水 |
取代 |
产生白色沉淀 |
| b |
氯化铁溶液 |
加成 |
溶液变成红色 |
| c |
酸性高锰酸钾溶液 |
还原 |
溶液紫色变浅 |
| d |
新制氢氧化铜(加热) |
氧化 |
产生红色沉淀 |
(2)有机物B在浓硫酸存在下,分子间相互作用生成一种环状酯,结构如下图所示: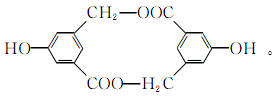
则有机物B的结构简式为________________,等物质的量的B与钠、氢氧化钠、碳酸氢钠完全反应,消耗钠、氢氧化钠、碳酸氢钠的物质的量之比为________。
(3)D和B互为同分异构体,且苯环上的一氯代物只有两种。D不与碳酸氢钠反应,能与钠、氢氧化钠反应,等物质的量D消耗钠、氢氧化钠的物质的量之比为23,则D的结构简式(只写一种):________________________________________________________________________。
(4)1 mol A和1 mol C完全燃烧,消耗氧气的质量相等,且1 mol C能与1 mol Na完全反应,写出含碳原子个数最少的C的结构简式:____________________。
某有机物含有C、H、O、N四种元素,下图是该有机物的球棍模型。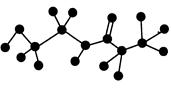
(1)该有机物分子式为________,结构简式为________。
(2)该有机物可能发生的反应有________。
①取代 ②消去 ③加聚 ④氧化 ⑤酯化 ⑥缩聚
(3)该有机物发生水解反应的化学方程式为________________________________________________。
萜品醇可作为消毒剂、抗氧化剂、医药和溶剂。合成α萜品醇G的路线之一如下: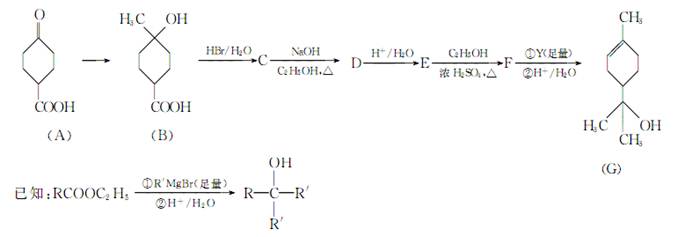
请回答下列问题:
(1)A所含官能团的名称是
________________________________________________________________________。
(2)A催化氢化得Z(C7H12O3),写出Z在一定条件下聚合反应的化学方程式:
________________________________________________________________________
________________________________________________________________________。
(3)B的分子式为________;写出同时满足下列条件的B的链状同分异构体的结构简式:
________________________________________________________________________
________________________________________________________________________。
①核磁共振氢谱有2个吸收峰
②能发生银镜反应
(4)B→C、E→F的反应类型分别为__________________、________________。
(5)C→D的化学方程式为
________________________________________________________________________
________________________________________________________________________。
(6)试剂Y的结构简式为
________________________________________________________________________。
(7)通过常温下的反应,区别E、F和G的试剂是________和________。
(8)G与H2O催化加成得不含手性碳原子(连有4个不同原子或原子团的碳原子叫手性碳原子)的化合物H,写出H的结构简式:_____________________________________________
______________。
有机合成粘合剂是生产和生活中一类重要的材料。黏合的过程一般是呈液态的粘合剂小分子,经化学反应转化为大分子或高分子而固化。
(1)“520胶”是一种快干胶,其成分为α氰基丙烯酸乙酯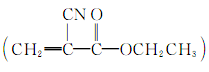 ,当暴露在空气中时,微量的水起催化作用,使其发生碳碳双键的加聚反应而迅速固化,几秒钟即可把被粘物牢牢粘在一起。请写出“520胶”发生粘合作用的化学方程式:
,当暴露在空气中时,微量的水起催化作用,使其发生碳碳双键的加聚反应而迅速固化,几秒钟即可把被粘物牢牢粘在一起。请写出“520胶”发生粘合作用的化学方程式:
________________________________________________________________________。
(2)厌氧胶(主要成分为 是另一种粘合剂,它与“520胶”不同,可在空气中长期储存,但在隔绝空气(缺氧)时,分子中的双键断开发生聚合而固化。在工业上用丙烯酸和某物质在一定条件下反应可制得这种粘合剂,则这一制取过程的化学方程式为________________________________________________________________________
是另一种粘合剂,它与“520胶”不同,可在空气中长期储存,但在隔绝空气(缺氧)时,分子中的双键断开发生聚合而固化。在工业上用丙烯酸和某物质在一定条件下反应可制得这种粘合剂,则这一制取过程的化学方程式为________________________________________________________________________
________________________________________________________________________。
橡胶树是热带植物,在我国海南有大面积的种植,从橡胶的乳胶中可提取天然橡胶,天然橡胶的成分是聚异戊二烯,其结构为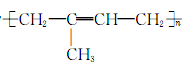 。试回答下列问题:
。试回答下列问题:
(1)天然橡胶能溶于汽油的原因是______________________________________
________,天然橡胶中加入适当硫进行硫化后,其结构由__________变成__________,因而硫化橡胶________(填“能”或“不能”)溶于汽油。
(2)天然橡胶是一种无色液体,该无色液体中加入溴水,溴水________(填“能”或“不能”)褪色。