A、B、C、D均为含苯环的化合物,且相对分子质量B>A>C,已知有机物A的分子式为C7H6O3,A分子中苯环上只有两个官能团,且苯环的一氯代物只有两种结构,A能与碳酸氢钠反应产生气体。
(1)A能与碳酸氢钠反应,写出该化学方程式:
________________________________________________________________________;少量A与下列试剂反应的反应类型、现象描述都正确的是________________。
| |
试剂 |
反应类型 |
实验现象 |
| a |
浓溴水 |
取代 |
产生白色沉淀 |
| b |
氯化铁溶液 |
加成 |
溶液变成红色 |
| c |
酸性高锰酸钾溶液 |
还原 |
溶液紫色变浅 |
| d |
新制氢氧化铜(加热) |
氧化 |
产生红色沉淀 |
(2)有机物B在浓硫酸存在下,分子间相互作用生成一种环状酯,结构如下图所示: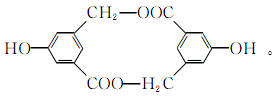
则有机物B的结构简式为________________,等物质的量的B与钠、氢氧化钠、碳酸氢钠完全反应,消耗钠、氢氧化钠、碳酸氢钠的物质的量之比为________。
(3)D和B互为同分异构体,且苯环上的一氯代物只有两种。D不与碳酸氢钠反应,能与钠、氢氧化钠反应,等物质的量D消耗钠、氢氧化钠的物质的量之比为23,则D的结构简式(只写一种):________________________________________________________________________。
(4)1 mol A和1 mol C完全燃烧,消耗氧气的质量相等,且1 mol C能与1 mol Na完全反应,写出含碳原子个数最少的C的结构简式:____________________。
向Na2CO3溶液中滴加酚酞呈红色的原因是 (用离子方程式表示);溶液中各离子浓度由大到小的顺序;向此溶液中加入AlCl3溶液,观察到的现象是,反应的离子方程式为。
(用离子方程式表示);溶液中各离子浓度由大到小的顺序;向此溶液中加入AlCl3溶液,观察到的现象是,反应的离子方程式为。
(10分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) 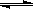 CH3OH(g)
CH3OH(g)
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=,升高温度,K值(填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a. 氢气的浓度减少 b. 正反应速率加快,逆反应速率也加快
c. 甲醇的物质的量增加 d. 重新平衡时n(H2)/n(CH3OH)增大
(4)据研 究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:(用化学方程式表示)
究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:(用化学方程式表示)
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+H2O(g)  CO(g)+H2(g)ΔH=+131.3 kJ•mol-1,ΔS=+133.7J•(K•mol) -1
CO(g)+H2(g)ΔH=+131.3 kJ•mol-1,ΔS=+133.7J•(K•mol) -1
①该反应能否自发进行与有关;
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是(填字母,下同)。
a.容器中的压强不变 b.1 mol H —H键断裂的同时断裂2 molH—O键
—H键断裂的同时断裂2 molH—O键
c.v正(CO) = v逆(H2O) d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应 CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/min |
||
| H2O |
CO |
H2 |
CO |
|||
| 1 |
650 |
2 |
4 |
1.6 |
2.4 |
5 |
| 2 |
900 |
1 |
2 |
0.4 |
1.6 |
3 |
| 3 |
900 |
a |
b |
c |
d |
t |
①实验1中以v(CO2) 表示的反应速率为 。
。
②该反应的逆反应为 (填“吸”或“放”)热反应
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:
CO2(g)+3H2(g)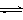 CH3OH(g)+H2O(g) ,右下图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是___________。
CH3OH(g)+H2O(g) ,右下图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是___________。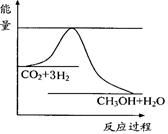
a.升高温度
b.充入He(g ),使体系压强增大
),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2
25℃时,50mL0.1mol/L醋酸中存在下述平衡:
若分别作如下改变,对上述平衡有何影响?
⑴加入少量冰醋酸,平衡将,溶液中c(H+)将(增大、减小、不变);
⑵加入一定量蒸馏水,平衡将,溶液中c(H+)将(增大、减小、不变)
⑶加入少量0.1mol/L盐酸,平衡将,溶液中c(H+)将(增大、减小、不变)
⑷加入20mL0.10mol/LNaCl,平衡将,溶液中c(H+)将(增大、减小、不变)
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如下图所示:
(1)上述氧化过程中,发生反应的离子方程式是:,控制反应温度30℃以下的原因是:。
(2)结晶过程中加入浓KOH溶液的作用是:。
(3)根据图1、图2回答:为了获取更多的高铁酸钾,铁盐的质量分数应控制在附近、反应时间应控制在。