超细铜粉主要应用于导电材料、催化剂等领域中。超细铜粉的某制备方法如下:
试回答下列问题:
(1)下列关于[Cu(NH3)4]SO4的说法中,正确的有__________。(填字母序号)
| A.[Cu(NH3)4]SO4中所含的化学键有离子键、极性键和配位键 |
| B.[Cu(NH3)4]SO4含有NH3分子,其水溶液中也含有NH3分子 |
| C.[Cu(NH3)4]SO4的组成元素中第一电离能最大的是氧元素 |
| D.[Cu(NH3)4]SO4的外界离子的空间构型为正四面体 |
(2)NH4CuSO3中的金属阳离子的核外电子排布式为_______________。
(3)SO2–3 离子中S硫原子的杂化方式为________,与其互为等电子体的一种分子的分子式是___________。
(4)NH3易液化的原因是___________________。
(5)右图是铜的某种氧化物的晶胞结构示意图,由此可确定该氧化物的化学式_____。
(6)NH4CuSO3与硫酸微热反应的离子方程式为__________________________。
已知X气体是一种无色有刺激性气味的酸性氧化物,有关X、Y、Z、W的转化
关系如下,反应①~④均为化合反应。回答下列问题: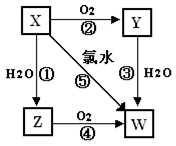
(1)Y的化学式为___________,Z的化学式为____________。X直接排入空气中易造成的环境问题是_______________________。
(2)反应①~⑤中属于可逆反应的是______________。
(3)反应⑤的化学方程式为:_______________________________________________。
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为
。
(2)漂白粉的有效成分是(填化学式)。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方为。
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号)。
(共6分)A、B、C是中学化学常见的三种有色物质,它们由Na、O、N、Cl等一种或两种元素组成,均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂。请写出A、B、C分别与水反应的离子方程式。
⑴ A与H2O __________________________________。
⑵ B与H2O _______________ __________________。
⑶ C与H2O __________________________________。
黏土是很多硅酸盐产品的原料之一,创造历史、享誉全球的景德镇陶瓷就是利用了当地的优质黏土资源。请回答下列问题:
(1)黏土主要有效成分的化学式为Al2Si2O5(OH)4,若以氧化物形式表示,应写为____________。
(2)在黏土资源丰富的地区还可以兴建水泥厂、玻璃厂、硫酸厂等,这些工厂中属于硅酸盐工业的有__________________,玻璃厂生产雕花玻璃过程所依据的化学原理是
________________________________________(用化学方程式表示)。
(11分)已知: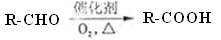
美国化学家R.F.Heck因发现如下Heck反应而获得2010年诺贝尔化学奖。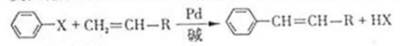
(X为卤原子,R为取代基)
经由Heck反应合成M(一种防晒剂)的路线如下: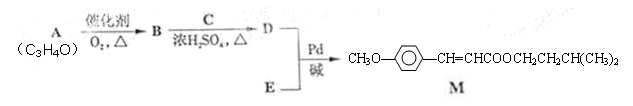
回答下列问题:
(1)M可发生的反应类型是______________。
a. 取代反应 b. 酯化反应 c. 消去反应 d. 加成反应
(2)C与浓H2SO4共热生成F,F能使酸性KMnO4溶液褪色,F的结构简式是___ ____。
D在一定条件下反应生成高分子化合物G,G的结构简式是______ ____。
(3)在A→B的反应中,检验A是否反应完全的试剂是_____ __________。
(4)E的一种同分异构体K符合下列条件:苯环上有两个取代基且苯环上只有两种不同化学环境的氢,与FeCl3溶液作用显紫色。K与过量NaOH溶液共热,发生反应的方程式为_______。