纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
| 方法Ⅰ |
用炭粉在高温条件下还原CuO |
| 方法Ⅱ |
电解法:2Cu+H2O  Cu2O+H2↑ Cu2O+H2↑ |
| 方法Ⅲ |
用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控温不当易生成 而使Cu2O产率降低。
(2)已知:①C(s)+O2(g)=CO2(g) △H=akJ·mol—1;
②2CO(g)+O2(g)=2CO2(g) △H=bkJ·mol—1;
③2Cu2O(s)+O2(g)=4CuO(s) △H=ckJ·mol—1.
方法Ⅰ制备过程会产生有毒气体,写出制备反应的热化学方程式 。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应式为 。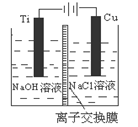
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 。
(5)方法Ⅲ可以用甲醛稀溶液替代肼,但因反应温度较高而使部分产品颗粒过大, (填操作名称)可分离出颗粒过大的Cu2O。
(6)在相同的密闭容器中,用方法Ⅱ和方法Ⅲ制得的Cu2O分别进行催化分解水的实验: ⊿H>0
⊿H>0
水蒸气的浓度(mol·L-1)随时间t (min)变化如下表:
| 序号 |
温度 |
0 |
10 |
20 |
30 |
40 |
50 |
| ① |
T1 |
0.050 |
0.0492 |
0.0486 |
0.0482 |
0.0480 |
0.0480 |
| ② |
T1 |
0.050 |
0.0488 |
0.0484 |
0.0480 |
0.0480 |
0.0480 |
| ③ |
T2 |
0.10 |
0.094 |
0.090 |
0.090 |
0.090 |
0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(O2)= ;实验温度T1 T2(填“>”、“<”);催化剂的催化效率:实验① 实验②(填“>”、“<”)。
比较法是化学中研究物质性质的基本方法之一,请运用比较法解答下题。Na2O2几乎可与所有的常见气态非金属氧化物反应。如2Na2O2+2CO2 ="=" 2Na2CO3+O2,Na2O2+CO= Na2CO3。
(1)通过比较可知,当非金属元素处于____________价时,其氧化物与Na2O2反应有O2生成。
(2)试分别写出Na2O2与SO2、SO3反应的化学方程式:_____________;_____________。
(3)氰(CN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素。试写出(CN)2与水反应的化学方程式:________________________________________。
试用化学方法除去下列物质中混有的少量杂质,要求除杂试剂均过量,若为溶液中的离子反应请写出其离子方程式,否则写化学方程式。并写出相应的分离方法。
(1)除去FeCl2溶液中混有的少量FeCl3;方程式: ______________。分离方法:______
(2)除去CO2气体中混有的少量HCl;方程式:_______________。分离方法:______
(3)除去NaCl溶液中混有的少量NaBr;方程式:__________________。分离方法:______
次磷酸(H3PO2)是一种精细化工产品,是一元中强酸,具有较强还原性。回答下列问题:
(1)H3PO2及NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①在H3PO2中,磷元素的化合价为;在酸性环境中,利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4︰1,则氧化产物为:(填化学式)。
②NaH2PO2是(填“正盐”还是“酸式盐”),其溶液中离子浓度由大到小的顺序应为
③0.2 mol·L-1 H3PO2溶液与0.2mol·L-1NaOH溶液等体积混合后所得溶液中:
c(H2PO2-)+c(OH-)-c(H+)=mol·L-1。(溶液体积变化忽略不计)
(2)次磷酸(H3PO2)可以通过电解的方法制备。工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
①写出阳极的电极反应式
②分析产品室可得到H3PO2的原因(用离子方程式表示)
在500℃时,将足量的A固体投入2.0L真空密闭容器中,发生A(s)  2B(g)+C(g)反应,测得气体C随时间的浓度变化如图所示
2B(g)+C(g)反应,测得气体C随时间的浓度变化如图所示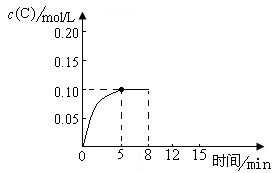
(1)已知该反应只有高温下能自发进行,则该反应的△H0(填“>”、“<”或“=”)。
(2)在上述反应条件下,从反应开始到平衡,用V(B)=mol·L-1·min-1,500℃时的平衡常数K=;
(3)在反应温度和容器体积不变的条件下,下列能说明上述反应达到平衡状态的是;
A.混合气体的压强保持不变
B.气体C的体积分数保持不变
C.混合气体的密度保持不变
D.B的正反应速率等于C的逆反应速率
(4)在500℃时,上述反应达到平衡后,在8min时将容器体积迅速压缩为1.0L,反应在12min建立新的平衡,画出8~15min内C气体物质的量浓度随时间变化的示意图。
运用甲烷自热来制取氢气是目前较为先进的技术。其涉及的反应如下:
①CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H1=+165.0 kJ/mol反应活化能Ea1="243.9" kJ/mol
②CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H2=-802.6 kJ/mol反应活化能Ea2="125.6" kJ/mol
(1)2H2(g) + O2(g)= 2H2O(g)△H3= kJ/mol;
(2)下面能正确表示氢气和氧气反应生成水的能量变化示意图的是(填字母序号)。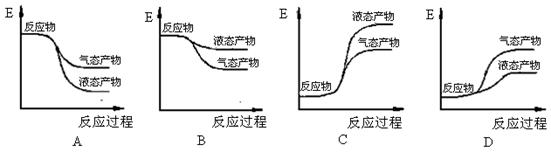
(3)运用甲烷自热来制取氢气是目前较为先进的技术。在同一反应系统同时通入甲烷、氧气和水蒸气,发生如上反应①和反应②,则反应开始时,反应①的反应速率反应②的反应速率(填“>”、“<”或“=”),理由是;从能量角度分析,在该制氢过程中通入适量氧气发生反应②的目的是;