运用甲烷自热来制取氢气是目前较为先进的技术。其涉及的反应如下:
①CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H1=+165.0 kJ/mol 反应活化能Ea1="243.9" kJ/mol
②CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H2=-802.6 kJ/mol 反应活化能Ea2="125.6" kJ/mol
(1)2H2(g) + O2(g)= 2H2O(g)△H3= kJ/mol;
(2)下面能正确表示氢气和氧气反应生成水的能量变化示意图的是 (填字母序号)。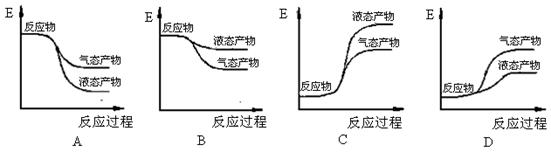
(3)运用甲烷自热来制取氢气是目前较为先进的技术。在同一反应系统同时通入甲烷、氧气和水蒸气,发生如上反应①和反应②,则反应开始时,反应①的反应速率 反应②的反应速率(填“>”、“<”或“=”),理由是 ;从能量角度分析,在该制氢过程中通入适量氧气发生反应②的目的是 ;
已知某溶液中只存在OH-、H+、 、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Cl-)>c( )>c(H+)>c(OH-)②c(Cl-)>c(
)>c(H+)>c(OH-)②c(Cl-)>c( )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
③c( )>c(Cl-)>c(OH-)>c(H+)④c(Cl-)>c(H+)>c(
)>c(Cl-)>c(OH-)>c(H+)④c(Cl-)>c(H+)>c( )>c(OH-)
)>c(OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是________,上述四种离子浓度的大小顺序为________(填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为________;若上述关系中④是正确的,则溶液中的溶质为________。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)________c(NH3·H2O)(填“大于”“小于”或“等于”,下同),混合前酸中c(H+)和碱中c(OH-)的关系:c(H+)________c(OH-)。
已知某溶液中只含有OH-、H+、Na+、CH3COO-四种离子。
(1)若溶液中只溶解了一种溶质,则该溶质是_______________。
(2)若溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-),则含有的溶质是___________。
(3)若溶液是由体积相等的NaOH溶液和CH3COOH溶液混合而成,且恰好呈中性,则混合前c(CH3COOH)________c(NaOH)(填“<”“>”或“=”)。
现有电解质溶液:①Na2CO3②NaHCO3③NaAlO2④CH3COONa⑤NaOH,且已知:CO2+3H2O+2 ====2Al(OH)3↓+
====2Al(OH)3↓+ 。
。
(1)当五种溶液的pH相同时,其物质的量浓度由大到小的顺序是________(填编号)。
(2)当上述物质的量浓度均为0.1mol·L-1的五种溶液,稀释相同倍数时,其pH变化最大的是________(填编号)。
(3)在上述五种电解质溶液中,分别加入AlCl3溶液,无气体产生的是________(填编号)。
(4)将上述①②③④这四种电解质溶液混合,发生反应的离子方程式为______________。
CuCl2溶液中含少量杂质FeCl2,为制备晶体CuCl2·2H2O,拟定实验步骤如下:
请完成下列问题:
(1)最适宜的氧化剂是_________。
| A.K2Cr2O7 | B.NaClO | C.H2O2 | D.KMnO4 |
(2)物质Y是_______________________。
(3)除去Fe3+的有关化学方程式是。
(4)为了防止水解,要得到CuCl2·2H2O,应控制的一定条件是______________。
已知某溶液中只存在OH-、H+、 和Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
和Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Cl-)>c( )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
②c(Cl-)>c( )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
③c( )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c( )>c(OH-)
)>c(OH-)
填写下列空白。
(1)若溶液中只溶解了一种溶质,则该溶质是____________,上述四种离子浓度的大小顺序为_________________(填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为____________,若上述关系中④是正确的,则溶液中的溶质为____________________。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)_________c(NH3·H2O)(填“大于”“小于”或“等于”,下同),混合前酸中c(H+)与碱中c(OH-)的关系是__________________。