比较法是化学中研究物质性质的基本方法之一,请运用比较法解答下题。Na2O2几乎可与所有的常见气态非金属氧化物反应。如2Na2O2+2CO2 ="=" 2Na2CO3+O2,Na2O2+CO= Na2CO3。
(1)通过比较可知,当非金属元素处于____________价时,其氧化物与Na2O2反应有O2生成。
(2)试分别写出Na2O2与SO2、SO3反应的化学方程式:_____________;_____________。
(3)氰(CN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素。试写出(CN)2与水反应的化学方程式:________________________________________。
松油醇是一种调香香精,它是α、β、γ三种同分异构体组成的混合物,可由松节油分馏产品A(下式中18是为区分两个羟基而人为加上去的)经下列反应制得:
(1)A的分子式为__________________。
(2)γ松油醇的结构简式为_________________。
(3)α松油醇能发生的反应类型是________________(填代号)。
a.加成反应
b.水解反应
c.氧化反应
d.消去反应
e.取代反应
(4)在许多香料中松油醇还有少量以酯的形式出现,写出CH3COOH和α松油醇反应的化学方程式____________________________________________________。
(1)写出下列各物质的名称,填入括号内。
CH4 → CH3Cl → CH3OH → HCHO → HCOOH → HCOOC2H5
(甲烷)→()→(甲醇)→()→()→()
(2)某有机物的结构简式如图:
①当其和________________反应时,可转化为 。
。
②当其和________________反应时,可转化为  。
。
③当和________________反应时,可转化为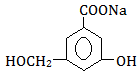 。
。
④欲将 转化为
转化为 ,则应加入__________________。
,则应加入__________________。
[选考—有机化学基础]
药用有机物A药用有机物A为一种无色液体,从A出发可发生如下一系列反应:
请回答:
(1)E中官能团的名称是___________;反应③的反应类型为.
(2)化合物F结构简式:.
(3)有机物A的同分异体甚多,其中属于酯类的化合物,且含有苯环结构的异构体有种.
(4)E的一种同分异构体H,已知H可以和金属钠反应放出氢气,且在一定条件下可发生银镜反应,试写出H的结构简式:______________________________________.
(5)写出反应①的化学方程式:______________________________________.
[选考—物质结构与性质]
三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池和液晶显示器制造中得到广泛应用.NF3是一种三角锥型分子,键角102°,沸点-129℃;可在铜的催化作用下由F2和过量NH3反应得到: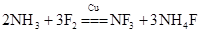
(1)上述化学方程式中的5种物质所含的化学键类型有(填序号).
a.离子键 b.共价键 c.配位键 d.金属键
(2)与铜属于同一周期,且未成对价电子数最多的元素基态原子价电子排布式为.
(3)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是_____________________.
(4)理论上HF、NaAlO2和NaCl按6∶1∶2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用.该物质为配合物,其中心离子是______________,配位数为_______________.
(5)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下面各题:
①在周期表中,最可能处于同一族的是和.
②T元素最可能是(填“s”、“p”、“d”、“ds”等)区元素.若T为第二周期元素,F是第三周期元素中原子半径最小的元素,则T、F形成化合物的空间构型为,其中心原子的杂化轨道类型为.
辉铜矿是冶炼铜的重要原料.
(1)工业上冶炼粗铜的某种反应为:Cu2S+O2===2Cu+SO2
①当产生标况下11.2L气体时,转移电子数目为;
②将粗铜进行电解精炼,粗铜应与外电源的极相接;若精炼某种仅含杂质锌的粗铜,通电一段时间后测得阴极增重ag,电解质溶液增重bg,则粗铜中含锌的质量分数为;
(2)将辉铜矿、软锰矿做如下处理,可以制得碱式碳酸铜:
①步骤I中用稀硫酸浸取矿石,为提高浸取率可采取的措施有(任写一种).
②步骤Ⅱ中调节浸出液pH=3.5的作用是;
③步骤Ⅰ中发生如下3个反应,已知反应i)中生成的硫酸铁起催化作用。请写出反应iii)的化学方程式。
i)Fe2O3+3H2SO4 = Fe2(SO4)3+3H2O
ii)Cu2S+ Fe2(SO4)3 = CuSO4+CuS+2FeSO4
iii)
④步骤Ⅱ中,碳酸氢铵参与反应的离子方程式为.