氢气、纳米技术制成的金属燃料、非金属固体燃料已应用到社会生活和高科技领域。
⑴已知短周期金属元素A和B,其单质单位质量的燃烧热大,可用作燃料。其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
| A |
899.5 |
1757.1 |
14848.7 |
21006.6 |
| B |
738 |
1451 |
7733 |
10540 |
①根据上述数据分析, B在周期表中位于 区,其最高价应为 ;
②若某同学将B原子的基态外围电子排布式写成了ns1np1,违反了 原理;
③B元素的第一电离能大于Al,原因是 ;
⑵氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由 。
②C60分子中每个碳原子只跟相邻的3个碳原子形成共价键,且每个碳原子最外层都满足8电子相对稳定结构,则C60分子中σ键与π键的数目之比为 。
胆矾(CuSO4·5H2O)是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。
完成下列各题:
Ⅰ.(1)向含铜粉的稀硫酸中滴加浓硝酸,随着铜粉的溶解可能观察到的实验现象、。
(2)制得的胆矾晶体(CuSO4·5H2O)中可能存在的杂质是(写化学式)。
(3)采用重量法测定CuSO4·5H2O的含量时,步骤如下:
①取样,称量②加水溶解③加氯化钡溶液生成沉淀④过滤(其余步骤省略)
在过滤前,需要检验是否沉淀完全,其操作是。
Ⅱ. 某研究性学习小组用ZRY-1型热重分析仪对12.5克硫酸铜晶体(CuSO4·5H2O)进行热重分析,随温度的升高,硫酸铜晶体依次发生下列反应。
a.CuSO4·5H2O CuSO4+5H2O
CuSO4+5H2O
b.CuSO4 CuO+SO3↑,2SO3
CuO+SO3↑,2SO3 2SO2+O2
2SO2+O2
c.4CuO 2Cu 2 O+O2↑
2Cu 2 O+O2↑
请回答下列问题:
(1)实验过程中热重分析仪测得残留固体质量为3.8 g,试推断该固体的组分是(写化学式),其对应的物质的量之比是。
(2)热重分析仪加热晶体至恒重后,将全部气体导出,通入氢氧化钡溶液充分反应,所得沉淀经过滤、洗涤、干燥,质量为g。
如图所示A管中装有Fe粉和适量的稀H2SO4,B管中装有足量的NaOH溶液。某同学用该装置制Fe(OH)2。完成下列填空:
(1)打开a,使A管中反应进行一段时间。
(2)夹紧止水夹a,在B管中可观察到的现象是:, B中发生反应的离子方程式为。
(3)该同学进行(1)操作的目的。
某研究性学习小组的同学想通过下图实验装置探究SO2与Na2O2反应的产物。(夹持装置已略去,装置的气密性良好)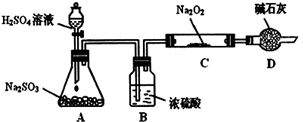
Ⅰ.实验中装置B可吸收水分,干燥SO2气体,其目的是:_________________________。
装置D除了吸收过量的SO2,避免污染空气外,还起到的作用是:_________________。
Ⅱ.对C中固体产物提出如下假设:(假设Na2O2已全部反应)
假设1:__________。 假设2:只有Na2SO4; 假设3:既有Na2SO3又有Na2SO4。
(1)甲同学认为SO2与Na2O2的反应不同于CO2,应为假设2成立,请据此写出C中所发生反应的化学方程式:_____________________。
(2)若假设2成立,为确定C中固体产物的成分,甲同学设计如下实验:
得出结论:C中固体产物只有Na2SO4。该方案是否合理?答:__________。(填“是”或“否”)理由是______________________________。
(3)乙同学为证明假设3成立,设计如下实验。
实验步骤和结论为:
①取少量C中固体产物于试管中,加入适量的蒸馏水溶解;
②滴加过量的1mol•L-1BaCl2溶液,若产生白色沉淀,则证明C中固体产物中有_________;
③滴加适量的1mol•L-1稀盐酸,若白色沉淀部分溶解,并产生刺激性气味气体,则证明C中固体产物中有___________________。
某化学小组为了证明SO2和Cl2的漂白性,设计了如下图所示的实验装置:
它们制备SO2和Cl2所依据的原理分别是:
Na2SO3+H2SO4= Na2SO4+H2O+SO2↑ MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)用来制取Cl2的装置是(填序号),反应中浓盐酸所表现出的化学性质是和
(2)反应开始一段时间后, B、D试管中的品红溶液均褪色。停止通气后,再给B、D两个试管分别加热,____ __ (填“B”或“D” )试管中无明显现象。
(3)装置C的作用是;
(4) 若装置D中的品红溶液换成紫色的石蕊溶液,则出现的现象是。
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是。
亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略)。
已知:室温下,①2NO+Na2O2→2NaNO2②3NaNO2+3HCl→3NaCl+HNO3+2NO↑+H2O;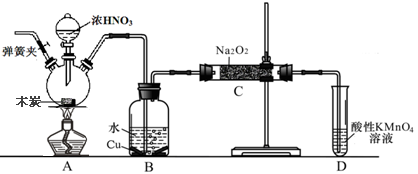
③酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
完成下列填空:
(1)写出浓硝酸与木炭反应的化学方程式。
(2)B中观察到的主要现象是,D装置的作用是。
(3)检验C中产物有亚硝酸钠的方法是。
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和,为避免产生这些副产物应在B、C装置间增加装置E,画出E并注明E中盛放的药品名称。
(5)写出检验C产物中是否含碳酸钠的方法。
(6)将1.56g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭g。