某研究性学习小组的同学想通过下图实验装置探究SO2与Na2O2反应的产物。(夹持装置已略去,装置的气密性良好)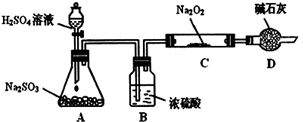
Ⅰ.实验中装置B可吸收水分,干燥SO2气体,其目的是:_________________________。
装置D除了吸收过量的SO2,避免污染空气外,还起到的作用是:_________________。
Ⅱ.对C中固体产物提出如下假设:(假设Na2O2已全部反应)
假设1:__________。 假设2:只有Na2SO4; 假设3:既有Na2SO3又有Na2SO4。
(1)甲同学认为SO2与Na2O2的反应不同于CO2,应为假设2成立,请据此写出C中所发生反应的化学方程式:_____________________。
(2)若假设2成立,为确定C中固体产物的成分,甲同学设计如下实验:
得出结论:C中固体产物只有Na2SO4。该方案是否合理?答:__________。(填“是”或“否”)理由是______________________________。
(3)乙同学为证明假设3成立,设计如下实验。
实验步骤和结论为:
①取少量C中固体产物于试管中,加入适量的蒸馏水溶解;
②滴加过量的1mol•L-1BaCl2溶液,若产生白色沉淀,则证明C中固体产物中有_________;
③滴加适量的1mol•L-1稀盐酸,若白色沉淀部分溶解,并产生刺激性气味气体,则证明C中固体产物中有___________________。
实验室制备乙酸乙酯的反应和实验装置如下:
CH3COOH + C2H5OH  CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
投料 1: 1产率 65%
1: 10 97%
(在120 ℃下测定)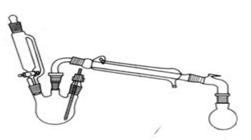
已知:相关物理性质(常温常压)
| 密度g/mL |
熔点/℃ |
沸点/℃ |
水溶性 |
|
| 乙醇 |
0.79 |
-114 |
78 |
溶 |
| 乙酸 |
1.049 |
16.2 |
~117 |
溶 |
| 乙酸乙酯 |
0.902 |
−84 |
~76.5 |
不溶 |
合成反应:
在三颈瓶中加入乙醇5 mL,硫酸5 mL,2小片碎瓷片。漏斗加入乙酸14.3 mL ,乙醇20 mL。冷凝管中通入冷却水后,开始缓慢加热,控制滴加速度等于蒸馏速度,反应温度不超过120 ℃。
分离提纯:
将反应粗产物倒入分液漏斗中,依次用少量饱和的Na2CO3溶液、饱和NaCl溶液、饱和CaCl2溶液洗涤,分离后加入无水碳酸钾,静置一段时间后弃去碳酸钾。最终通过蒸馏得到纯净的乙酸乙酯。
回答下列问题:
(1)酯化反应的机制
用乙醇羟基氧示踪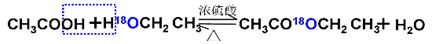
用醋酸羟基氧示踪


含氧18水占到总水量的一半,酯也一样。这个实验推翻了酯化反应为简单的取代反应。请你设想酯化反应的机制。
(2)酯化反应是一个可逆的反应,120 ℃时,平衡常数K=。
为了使正反应有利,通常采用的手段是:
①使原料之一过量。谁过量 ?
无水乙醇3600元/吨,冰醋酸2900元/吨。每摩乙醇元,每摩冰醋酸元。
②不断移走产物[例如除水,乙酸乙酯、乙醇、水可形成三元恒沸物(沸点:70.2 ℃),乙酸不能形成三元恒沸物]。综上所述选择过量。
(3)加入碎瓷片的作用是________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填正确答案标号)。
A.立即补加B.冷却后补加 C.不需补加 D.重新配料
(4)浓硫酸与乙醇如何混合?。
(5)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是?。
(6)蒸出的粗乙酸乙酯中主要有哪些杂质?。
饱和的Na2CO3溶液洗涤除去乙酸。如何判断是否除净?。
用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,为什么不用水?。
用饱和CaCl2溶液直接洗涤起什么作用:。
铜与浓硫酸反应,实验装置如图所示。
(1) 装置A中发生反应的化学方程式为: ,反应过程中试管B中的现象是 ,试管C的作用是 。
(2) 导管D的下端(虚线段)应位于 (液面上、液面下),导管D的作用有:①实验结束后排除装置中的SO2;② 。
实验中发现试管内除了产生白色固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有CuO、Cu2O、CuS、Cu2S。为探究甲的成分,进行了以下的实验。
查阅资料可知:Cu2O + 2HCl =CuCl2+ Cu + H2O, 2Cu2O + O2煅烧 4CuO,2CuS+3O2煅烧2CuO+2SO2,Cu2S+2O2煅烧2CuO+SO2。CuS、 Cu2S和稀HCl不反应。
|

工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下: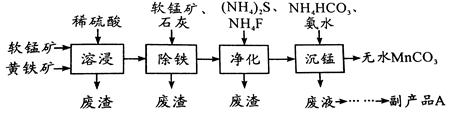
回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,可以采取的措施有(写一条)。
(2)除铁工序中,在加入石灰调节溶液的pH前,加入适量的软锰矿,其作用是:
。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)="0.01" mol•L-1,滤液中残留的c(Ca2+)=〔已知:Ksp(CaF2)=1.46×10-10〕,
(4)沉锰工序中,298K、c(Mn2+)为1.05 mol•L-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如图所示。根据图中信息得出的结论是。
(5)沉锰工序中有CO2生成,则生成MnCO3的离子方程式是。
(6)从沉锰工序中得到纯净MnCO3的操作方法是。
副产品A的化学式是。
(14分)近年来我国的航天事业取得了巨大的成就,在航天发射时,肼(N2H4)及其衍生物常用作火箭推进剂。
⑴液态肼作火箭燃料时,与液态N2O4混合发生氧化还原反应,已知每1 g肼充分反应后生成气态水放出热量为a KJ,试写出该反应的热化学方程式。
⑵在实验室中,用N2H4·H2O与NaOH颗粒一起蒸馏,收集114~116 ℃的馏分即为无水肼。
①在蒸馏过程中不需要的仪器是(填序号字母)。
| A.酒精灯 | B.长直玻璃导管 | C.锥形瓶 | D.冷凝管 |
E.牛角管(接液管) F.蒸馏烧瓶 G.酸式滴定管
②除上述必需的仪器外,还缺少的玻璃仪器是。
⑶肼能使锅炉内壁的铁锈(主要成分Fe2O3)变成磁性氧化铁(Fe3O4)层,可减缓锅炉锈蚀。若反应过程中肼转化为氮气,则每生成1 mol Fe3O4,需要消耗肼的质量为g。
⑷磁性氧化铁(Fe3O4)的组成可写成FeO·Fe2O3。某化学实验小组通过实验来探究一黑色粉末是否由Fe3O4、CuO组成(不含有其它黑色物质)。探究过程如下:
提出假设:假设1. 黑色粉末是CuO;假设2. 黑色粉末是Fe3O4;
假设3.。
设计探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
①若假设1成立,则实验现象是。
②若所得溶液显血红色,则假设成立。
③为进一步探究,继续向所得溶液加入足量铁粉,若产生的现象,则假设3成立。
有另一小组同学提出,若混合物中CuO含量较少,可能加入铁粉后实验现象不明显。
查阅资料:Cu2+与足量氨水反应生成深蓝色溶液,Cu2++4NH3·H2O=Cu(NH3)42++4H2O。
④为探究是假设2还是假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氨水,若假设2成立,则产生现象;若产生现象,则假设3成立。
下列实验操作都能达到预期目的的是( )
①蒸干AlCl3溶液可得纯净的无水氯化铝;②纸层析法分离铁离子和铜离子实验中,点样后的滤纸需晾干后,才能将滤纸下端浸入展开剂中进行实验;③用广泛pH试纸测得某溶液pH为3.5;④滴入酚酞溶液确定纯碱中有无烧碱;⑤用米汤直接检验食用盐中是否含有碘元素;⑥用酸式滴定管量取20.00 mL高锰酸钾酸性溶液;⑦用溴的四氯化碳溶液除去混在甲烷中的乙烯气体
| A.⑥⑦ | B.②⑥ | C.⑤⑥⑦ | D.只有⑥ |