某小组同学将一定浓度NaHCO3溶液加入到CuSO4溶液中发现生成了沉淀。甲同学认为沉淀是CuCO3;乙同学认为沉淀是CuCO3和Cu(OH)2的混合物,他们设计实验测定沉淀中CuCO3的质量分数。
(1)按照甲同学的观点,发生反应的离子方程式为 。
(2)两同学利用下图所示装置进行测定: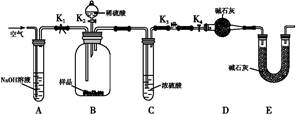
①在研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为过滤、洗涤、干燥。
②装置E中碱石灰的作用是 。
③实验过程中有以下操作步骤:
a.关闭K1、K3,打开K2、K4,充分反应
b.打开K1、K4,关闭K2、K3,通入过量空气
c.打开K1、K3,关闭K2、K4,通入过量空气
正确的顺序是 (填选项序号,下同)。若未进行步骤 ,将使测量结果偏低。
④若沉淀样品质量为m g,装置D质量增加了n g,则沉淀中CuCO3的质量分数为 。
(3)丙同学认为还可以通过测量CO2的体积并测量 来测定沉淀中CuCO3的质量分数。
某实验需要100 mL、0.1 mol/L的Na2CO3溶液,现通过如下操作配制:
①把称量好的固体Na2CO3放入小烧杯中,加适量蒸馏水溶解。为加快溶解可以使用________(填仪器名称)搅拌;②把①所得溶液冷却到室温后,小心转入________(填仪器名称);③继续加蒸馏水至液面距刻度线1~2 cm处,改用________(填仪器名称)小心滴加蒸馏水至溶液凹液面最低点与刻度线相切;④用少量蒸馏水洗涤玻璃棒和烧杯2~3次,每次洗涤的溶液都小心转入容量瓶,并轻轻摇匀;⑤将容量瓶塞紧,充分摇匀。
(1)操作步骤正确的顺序是________(填序号)。
(2)若没有操作④,则所配溶液的浓度会________(填“偏高”或“偏低”)。
(3)若取出20 mL配好的Na2CO3溶液,加蒸馏水稀释成c(Na+)=0.01 mol/L的溶液,则稀释后溶液的体积为________mL。
(4)在配制100 mL 0.1 mol/L的Na2CO3溶液时,下列操作中的________会导致结果偏低(请用序号填写)。
①用托盘天平称量时砝码放在左盘 ②将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外 ③定容时俯视刻度线 ④定容时仰视刻度线 ⑤干净的容量瓶未经干燥就用于配制溶液
乳酸亚铁([CH3CH(OH)COO]2Fe·3H2O,M=288g/mol)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:
CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe·3H2O+CO2↑。
已知FeCO3易被氧化:4FeCO3+6H2O+O2=4Fe(OH)3+4CO2
某兴趣小组用FeCl2(用铁粉和稀盐酸制得)和NH4HCO3制备FeCO3的装置示意图如下: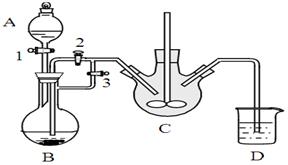
|
氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂,某化学小组的同学在老师的指导下制备氢化钙。
【查阅资料】
氢化钙通常用氢气与钙加热制得。
氢化钙要密封保存,遇水反应生成氢氧化钙和氢气。
钙遇水立即发生剧烈反应生成氢氧化钙和氢气,并放出大量的热。
标准状况下氢气的密度为0.09g/L。
【进行实验】小组同学设计的制取装置如下图所示(固定装置略)。
回答下列问题:
(1)写出A中发生反应的化学方程式 。
(2)B、D中所盛试剂相同,该试剂为 ,其作用分别是 、 。
(3)实验时先打开A中活塞,一段时间后,再点燃C中酒精灯,其目的是 。
(4)装置C中制取氢化钙的化学方程式是 。
【实验反思】小组同学通过反思提出问题:上述制得的氢化钙是否纯净?
他们再次设计实验进行检验,实验步骤如下:
步骤1:检查装置气密性,装入足量的水和已称好质量的氢化钙样品,按图所示连接仪器(固定装置略).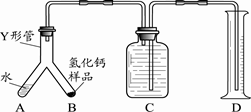
步骤2:将Y形管倾斜,使A中的水全部进入B中,完全反应后,冷却至室温,读取量筒读数.
通过上述实验可分析出制得的氢化钙是否纯净,其依据是______.
【化学——选修2:化学与技术】
常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
(1)填充物用60℃温水溶解,目的是 。
(2)操作A的名称为 。
(3)铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。铜帽溶解完全后,可采用_________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池电解质为KOH,总反应Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有 mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该应的化学方程式: 。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:
根据上图可知:
①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率 。
②在强酸性环境下Hg的吸收率高的原因可能是KMnO4在酸性条件下 强。
某化学兴趣小组的同学为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,他们开展了如下探究性学习。
I.查阅资料,获取了相关知识信息:
金属的活泼性不同,其硝酸盐分解产物不同,依据金属活动顺序表:
(1)K→Na等活泼金属的硝酸盐分解生成亚硝酸盐和氧气,如:2NaNO3 2NaNO2+O2↑;
2NaNO2+O2↑;
(2)Mg→Cu等较活泼金属的硝酸盐分解生成氧化物、NO2和O2,如:2Cu(NO3)2 2CuO+4NO2↑+O2↑;
2CuO+4NO2↑+O2↑;
(3)Hg以后不活泼金属的硝酸盐分解生成金属、NO2和O2,如:2AgNO3 2Ag+2NO2↑+O2↑.
2Ag+2NO2↑+O2↑.
Ⅱ.实验探究,在实验的基础上得到相关结论:
【实验一】探究Fe(NO3)2热分解固体产物中Fe元素的价态.该小组甲同学将Fe(NO3)2热分解固体产物溶于足量的稀H2SO4得到相应两份溶液,进行以下探究实验.
(1)提出猜想:猜想一:Fe元素只显+2价;
猜想二:Fe元素只显+3价;
猜想三:Fe元素既有+2价又有+3价。
(2)实验操作:①向一份溶液中滴入KSCN溶液;②向另一份溶液中滴入___________溶液。
(3)实验现象:实验①_________;实验②溶液不褪色。
(4)实验结论:猜想二成立,Fe(NO3)2分解的化学方程式是______________________。
【实验二】探究Fe(NO3)2热分解气体产物的性质.小组乙、丙同学进行了如图所示的实验(收集时操作恰当,几乎没有空气):
实验步骤:①连接仪器;②检查装置气密性;③取一定质量Fe(NO3)2装于大试管中,并重新连接好仪器;④加热;⑤…
(1)乙同学使用Ⅰ装置收集气体,恰好收集到27mL红棕色气体。
(2)丙同学取等质量的Fe(NO3)2同样条件下热分解,并使用Ⅱ装置收集气体产物,可收集到_____ mL气体。【实验三】探究固体混合物的组成和特征.
(1)小组丁同学取KNO3、Cu(NO3)2、Fe(NO3)2的混合粉末充分加热后用排水法未收集到任何气体,则KNO3、Cu(NO3)2、Fe(NO3)2的物质的量之比可能是________(填字母序号)。
| A.1:2:3 | B.l:2:2 | C.2:1:3 | D.3:8:5 |
(2)若取按上述比例混合的固体硝酸盐1mol溶于200mL 3mol•L-1的硫酸中,再向溶液中加入铜片,可溶解的铜的最大质量为__________g。