向盛有KI溶液的试管中滴加氯水后再加入少许CCl4,充分振荡后CCl4层呈紫色。如果继续向试管中滴加氯水,充分振荡,CCl4层又会逐渐变浅,最后变成无色。根据以上信息完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式,并用双线桥法标出电子转移的方向和数目: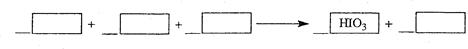
(2)实验中的有机溶剂CCl4还可以用 代替。
| A.苯 | B.煤油 | C.酒精 | D.醋酸 |
(3)若把KI换成KBr,则CCl4层变为 色;继续滴加氯水,CCl4层的颜色没有变化。则Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。
(4)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含KIO3的食盐)1000kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2________L(标准状况,计算结果保留1位小数)。
硅单质及其化合物应用范围很广。请回答下列问题:
制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下: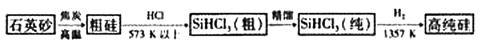
(1)在制粗硅的反应中,焦炭的作用是。
(2)整个制备过程必须严格控制无水、无氧。
①SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式 ;②H2还原SiHCl3过程中若混O2,可能引起的后果是。
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。写出
实验现象并给予解释 。
将羧酸的碱金属盐电解可得到烃类化合物。例如:
2CH3COOK+2H2O CH3-CH3+2CO2↑+H2↑+2KOH
CH3-CH3+2CO2↑+H2↑+2KOH
请根据下列表示的衍变关系,回答问题。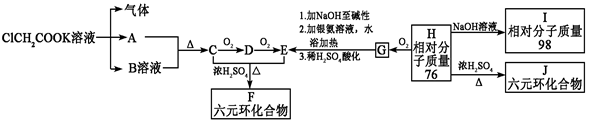
(1)写出下列物质的结构简式A: E: I
(2)G能发生反应的类型有(填序号):
a.取代 b.加成 c.还原 d.氧化 e.消去 f.水解
(3)写出H的最简单的两种同系物的结构简式,。
(4)F与J的关系为(填序号) a.同一物质 b.同系物 c.同分异构体 d.同素异形体
(5)写出下列过程的化学方程式:
C→D: C+E→F:
10分)A、B、C、D、E是位于短周期的主族元素,其中A、B为金属元素。已知:①热稳定性:HmD>HmC;②Cm-、E(m-1)-具有相同的电子层结构;③B与E在同一周期,在该周期中,E的原子半径最小,B的离子半径最小;④A、B所形成的单核离子具有相同的电子层结构,B的最高价氧化物对应的水化物与A、E的最高价氧化物对应的水化物都能反应。依据上述信息回答下列问题:(1)HmD的电子式:___________________。
(2)Cm-、E(m-1)-的还原性强弱为___________>___________(填离子符号),能证明其
还原性强弱的离子方程式为。
(3)写出B的最高价氧化物对应的水化物和A的最高价氧化物对应的水化物反应的离子方程式_________________________________________________________。
(4)在B、C、E单质中,符合下列转化关系的是___________。(填元素符号)
有下列转化关系:
(1)若C是可用于自来水消毒的气体,A生成的B的反应为工业上冶炼金属B的反应,反应条件为电解,D、E是氧化物,D转化为E时增加氧的质量是总质量的25.8%,则写出A在一定条件下生成的C方程式, E的电子式为
(2)若E是酸酐,且为无色易挥发的晶体,A为气态氢化物,则A与D反应生成B的化学方程式为 。
填空:
(1)在测定硫酸铜结晶水含量实验过程中,称量操作至少进行次。当加热到
时,停止加热,并将坩埚放在中冷却。当时则可认为结晶水已经完全失去。实际操作中,有些操作会使实验结果偏高或偏低。下列操作会使测定结果偏高的是(填字母)
| A.加热温度过高而使硫酸铜部分分解 | B.坩埚用水洗后没有烘干 |
| C.加热后放在空气中冷却 | D.粉末未完全变白就停止加热 |
(2)同素异形体相互转化的反应热相当小而且转化速度较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的观点“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”来研究。已知: P4(s、白磷)+5O2(g)=P4O10(s);△H=-2983.2kJ·mol-1
P(s、红磷)+5/4O2(g)=1/4P4O10(s);△H=-738.5kJ·mol-1
由此可知白磷的稳定性比红磷_____。(填写“强”或“弱”)