一个化学电池的总反应方程式为:Zn+Cu2+==Zn2++Cu,该化学电池的组成可能为 ( )
A B C D
正极 Cu Cu Zn Fe
负极 Zn Zn Cu Zn
电解质溶液 H2SO4 CuSO4 ZnCl2 CuCl2
某温度下,H2(g)+CO2(g)  H2O(g)+CO(g)的平衡常数K=9/4 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示:
H2O(g)+CO(g)的平衡常数K=9/4 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示:
| 起始浓度 |
甲 |
乙 |
丙 |
| c(H2)/ mol·L-1 |
0.010 |
0.020 |
0.020 |
| c(CO2) / mol·L-1 |
0.010 |
0.010 |
0.020 |
下列判断不正确的是( )
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中CO2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol·L-1
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
用CH4催化还原NOx可以消除氮氧化物的污染。例如:
① CH4 (g)+4NO2(g)=4NO(g) +CO2(g)+2H2O(g)△H=-574 kJ·mol-1;
② CH4 (g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160 kJ·mol-1。
下列说法不正确的是( )
| A.由反应①、②可推知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)ΔH=-867 kJ·mol-1 |
| B.等物质的量的甲烷分别参与反应①、②,则反应转移的电子数相等 |
| C.若用标准状况下4.48 L CH4还原NO2至N2,放出的热量为173.4 kJ |
| D.若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为3.2NA |
在一定条件下,某密闭容器内,SO2氧化成SO3的热化学方程式为:2SO2(g)+O2(g) 2SO3(g)△H =-a kJ·mol-1。在相同条件下,要想得到2a kJ的热量,加入各物质的物质的量可能是( )
2SO3(g)△H =-a kJ·mol-1。在相同条件下,要想得到2a kJ的热量,加入各物质的物质的量可能是( )
| A.4mol SO2和2mol O2 | B.5mol SO2和3mol O2 |
| C.4mol SO2和4mol O2 | D.4mol SO2、2mol O2和2mol SO3 |
下图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色。为实现铁上镀铜,接通
上的c点显红色。为实现铁上镀铜,接通 后,使c、d两点短路。下列叙述正确的是( )
后,使c、d两点短路。下列叙述正确的是( )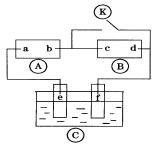
| A.a为直流电源的负极 | B.f电极为铁件 |
| C.c极发生的反应为O2+4e-+2H2O=4OH- | D.电解质溶液不能用CuCl2溶液 |
实验室用未知浓度的NaOH溶液滴定20.00mL0.1000 mol·L-1HCl溶液,以测定NaOH溶液的浓度,下列有关判断正确的是 ( )
| A.若碱式滴定管未用NaOH溶液润洗,则测定结果偏高 |
| B.装标准盐酸的锥形瓶用标准盐酸润洗会使滴定结果偏高 |
| C.取用标准盐酸的酸式滴定管未润洗会使测定结果偏高 |
| D.滴定前仰视读数,滴定后俯视液面读数会使测定结果偏低 |