等电子体具有相似的电子结构、几何构型和性质。
(1)SO2、O3、NO2-三种粒子是等电子体,此三种粒子的立体构型为__________。
(2)C2O42-和 (分子)是等电子体,C2O42-离子具有较强的还原性,它能使酸性KMnO4溶液褪色,写出此反应的离子方程式:
(3)由双原子构成,总电子数为14的等电子体共同特点是物质中都具有共价三键,请举出相应的3个例子 (分子或离子)。每个分子或离子中含______个π键。
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)用电子式表示X与W组成的化合物的形成过程;
(2)由X与Z组成的某化合物中存在非极性键,则该化合物的分子式为;
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液不能与铜反应,浓溶液能与铜在加热条件下反应,该反应的化学方程式为:;
(4)由X、Y、Z、W四种元素组成的一种离子化合物A
①已知1molA能与足量NaOH浓溶液反应生成标准状况下44.8L气体。写出加热条件下A与NaOH浓溶液反应的离子方程式:;
②又知A既能与盐酸反应,又能与氯水反应,写出与盐酸反应的离子方程式:;
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1molB中含有6 mol结晶水。对化合物B进行如下实验:
取B的溶液加入足量的NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
另取B的溶液,加入过量的BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解.
由上述实验现象可知:B的化学式为。
(1)研究性学习小组为了证明铁的金属性比铜强,他设计了如下几种方案,其中合理的是(填序号)
| A.铁片置于硫酸铜溶液中有铜析出; |
| B.铁、铜与氯气反应分别生成FeCl3、CuCl2; |
| C.铜片置于FeCl3溶液中,铜片逐渐溶解(2FeCl3+Cu="2" FeCl2+ CuCl2) |
| D.铁片、铜片分别置于盛有稀硫酸的烧杯中,铁片上有气泡产生,而铜片无气泡 |
E.常温下,分别将铁片和铜片置于浓硝酸中,铁片不溶解,而铜片溶解
(2)请你另设计一个能证明铁的金属活动性比铜强的实验。要求:
a.此方案的原理不同于上述任一合理方案;b.绘出实验装置图并注明所需的药品;
c.写出实验过程中的主要实验现象。
| 实验装置 |
实验现象 |
实验结论 |
某温度时,在一个2L的密闭容器中,H2、N2、NH3三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,回答下列问题: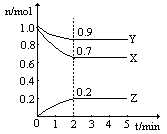
(1)图中X曲线代表(填化学式);
(2)从开始至2min,NH3的平均反应速率是;
(3)第4分钟时下列叙述正确的是;
| A.该反应已停止 |
| B.单位时间内氮气的消耗速率等于氢气的生成速率 |
| C.3v(H2)=2v(NH3) |
| D.c(H2) :c(N2) :c(NH3) =" 7" :9 :2 |
(4)若拆开1 mol H—H键,1 mol N—H键,1 mol N≡N键分别需要吸收的能量为436 kJ,391 kJ,946 kJ。则1 mol N2与3mol H2反应完全转化为NH3应_________热量(填“吸收”或“放出”)kJ。
欲探究氯气与碘单质的氧化性强弱,某同学设计了如下装置(用浓盐酸和KMnO4固体反应制取氯气)。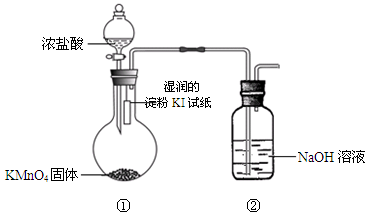
请回答:
(1)实验中观察到湿润的淀粉KI试纸,写出其中发生的置换反应的离子方程式: 。
(2)实验结论:氯单质的非金属性比碘单质的(填“强”或“弱”)。从原子结构角度解释:氯和碘位于周期表中族,该族元素从上到下,,得电子能力减弱。
(3)装置②的作用是。
写出相应的化学方程式:
能源是现代社会发展的三大支柱之一。化学在提高能源的利用率和开发新能源中起到了重要的作用。
(1)下列说法中,正确的是。(填序号)
| A.煤、石油和天然气都是可再生的能源 |
| B.目前使用的手机电池为二次电池,放电时是将化学能转化为电能 |
| C.人体运动所消耗的能量与化学反应无关 |
| D.人类目前所直接利用的能量大部分是由化学反应产生的 |
(2)电能是现代社会中应用最广泛的二次能源,下列装置中能够实现化学能转化为电能的是(填序号)。写出该装置正极反应的电极反应式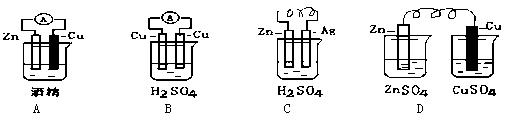
(3)锌锰干电池是目前使用最广泛的一种电池,其正极材料是石墨棒,它在放电时总反应式可表示为:Zn+ 2 MnO2 + 2 NH4+ ="=" Zn2+ + Mn2O3(S)+ 2NH3 + H2O。写出该电池负极反应的电极反应式。当电极锌消耗6.5g时,可对外提供的电子是mol。
(4)右图是氢氧燃料电池构造示意图(电解质溶液为稀硫酸)。关于该电池的说法不正确的是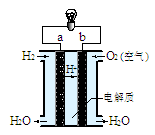
①.a极是负极
②.正极的电极反应是:O2+2H2O+4e-=4OH-
③.该装置可以将化学能完全转化为电能
④.氢氧燃料电池是环保电池
(5)人类在使用能源的过程中会产生环境问题。利用化学反应可以有效的进行治理。减少汽车等机动车尾气污染可在汽车尾气系统中增加催化转化装置,尾气中的CO、NO在催化剂的作用下反应生成两种参与大气循环的无毒气体,写出该反应的化学方程式。