海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。
(1)在光照条件下,氯气和氢气反应过程如下:
①Cl2―→Cl+Cl ②Cl+H2―→HCl+H ③H+Cl2―→HCl+Cl ……
反应②中形成的化合物的电子式为______;反应③中被破坏的化学键属于______键(填“极性”或“非极性”)。
(2)在短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是________ (用元素符号表示)。与氯元素同周期且金属性最强的元素位于周期表的第________周期________族。
(3)卤素单质及化合物在许多性质上都存在着递变规律。下列有关说法正确的是____。
a.卤化银的颜色按AgCl、AgBr、AgI的顺序依次加深
b.卤化氢的键长按H—F、H—Cl、H—Br、H—I的顺序依次减小
c.卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
d.卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易
(4)卤素单质的键能大小如图。由图推断: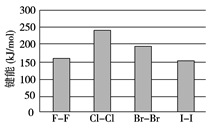
①非金属性强的卤素,其单质分子的化学键________断裂(填“容易”或“不容易”或“不一定容易”)。
②卤素单质键能大小与键长的关系为:______________________________________。
取100mL的Na2CO3和Na2SO4混合溶液,加入100 mL Ba(OH)2溶液,恰好完全反应,过滤得到白色沉淀和滤液,沉淀干燥后质量为14.51g。用过量稀盐酸处理上述沉淀,沉淀质量减少到4.66g,并有气体放出。计算:
⑴ 原混合液中Na2SO4的物质的量浓度为mol ·L-1;
⑵ 过滤出沉淀后,所得滤液的物质的量浓度为mol ·L-1(设反应前后溶液的密度均为1g·cm-3,且反应前后溶液体积变化忽略不计);
⑶在处理沉淀时产生的气体在标准状况下的体积为L。
下图所涉及的物质均为中学化学中的常见物质,其中:①C、D、E、F都为单质,其余为化合物;②C、D、E 在常温下为气体,其它物质为固体或液体;③A、I 两种化合物的焰色反应分别为紫色和黄色;④反应①、②中的一些生成物已经略去,有些反应的条件未列出,它们存在如下转化关系。
⑴ 写出有关物质的化学式:
A,D,F,I。
⑵ 指出MnO2在相关反应中的作用:反应①中是剂,反应②中是剂。
⑶ 写出B与MnO2共热获得D的化学方程式____________________________________。
海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
⑴ 海水中含有大量的氯化钠。请写出氯离子结构示意图。
⑵ 目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是(填物理变化、化学变化)。
⑶ 工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”。电解饱和食盐水的化学方程式为。
⑷ 近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如下: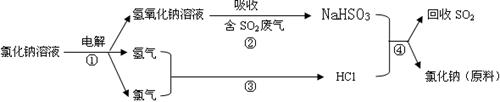
已知SO2和CO2都属于酸性氧化物,试写出②④的化学反应方程式:
②__________________________________;④_____________________________________。
(1)相同质量的臭氧(O3)和氧气(O2)所含的分子数之比是__________,所含原子数目之比是__________,在标准状况下所占的气体体积比是____________。
(2)在2KMnO4 + 16HCl="2KCl" +2MnCl2 + 5Cl2↑+ 8H2O反应中,若被氧化的HCl是0.4mol,则反应生成_________克氯气,转移的电子数是_______________个。
(3)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
①工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,写出化学反应方程式并用双线桥标出电子转移情况。
②漂白粉的有效成分是(填化学式)。
某研究性学习小组为了证明某酸HmA是强酸还是弱酸,设计了如下实验方案,请回答有关问题:
⑴当m=1时,测定0.1mol/L HA的pH值,若0.1mol/L HA的pH>1,说明HA为酸(填“强”、 “弱”)。
测定0.1mol/L HA的值时,pH试纸预先用蒸馏水湿润(填“能”、“不能”)。
⑵取少量NamA固体溶于蒸馏水,再向得到的溶液中滴加2滴石蕊,若溶液由无色变成蓝色,证明HmA是酸(填“强”、 “弱”)。
若某浓度的NamA溶液pH=9,则该溶液中,水电离的C(H+)= mol/L
⑶室温下,将pH=2的酸HmA和pH=12的B(OH)n等体积混合,测得混合液的pH=8。
①写出生成正盐的化学方程式
②若该盐中只有一种能水解的离子,则HmA为酸(填“强”、 “弱”), 离子水解的方程式为
⑷现有某浓度的HmA溶液,蒸馏水,常见指示剂(如:石蕊、酚酞),pH试纸以及常用实验仪器,请你设计一种简单可行的实验方案,证明HmA是强酸还是弱酸。简述实验过程、现象、结论:
。