海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
⑴ 海水中含有大量的氯化钠。请写出氯离子结构示意图 。
⑵ 目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是 (填物理变化、化学变化)。
⑶ 工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”。电解饱和食盐水的化学方程式为 。
⑷ 近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如下: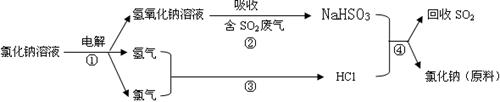
已知SO2和CO2都属于酸性氧化物,试写出②④的化学反应方程式:
②__________________________________;④_____________________________________。
合成高分子材料用途广泛、性能优异,其功能与分子结构有密切的关系。下面是几种高分子材料的结构简式:
(1)A是天然橡胶的主要成分,易老化,A中含有的官能团的名称是____________。
(2)B的单体是苯酚和___________,这两种单体在碱催化下,可得到网状高分子化合物,俗称电木,是热固性塑料。
(3)C与NaOH溶液在一定条件下反应,生成高吸水性树脂,该树脂的结构简式是___________________________________。
(4)D是合成纤维中目前产量第一的聚酯纤维——涤纶,可由两种单体在一定条件下合成,该合成反应的两种单体是________________。
请根据官能团的不同对下列有机物进行分类:
(1)属于芳香烃的;(2)属于醇类的有;
(3)含有醛基的有;(4)属于羧酸的有。
目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:
提示: ①MgCl2晶体的化学式为MgCl2•6H2O;
②MgO的熔点为2852℃,无水MgCl2的熔点为714℃。
(1)操作①的名称是 , 操作②的名称、、过滤。
(2)试剂a的名称是。
(3)用氯化镁电解生产金属镁的化学方程式为:。
(4)工业上是将氢氧化镁转变为氯化镁,再电解氯化镁来制取镁单质;而不采用:加热Mg(OH)2得到MgO,再电解熔融MgO的方法制金属镁,其原因是 。
(12分)乙烯是重要化工原料,其产量是一个国家石油化工水平的标志。通过石油裂解可以获得乙烯,再以乙烯为原料还可以合成很多的化工产品。已知乙烯能发生以下转化:
(1)乙烯的结构简式为 。
(2)反应①的反应类型是,D中含官能团名称为。
(3)写出以下反应的化学方程式:
①;②;
③。
(14分)下面是元素周期表的一部分。据A至H在周期表中位置,请回答下列问题:
| A |
|||||||||||||||||
| E |
G |
||||||||||||||||
| B |
C |
D |
F |
H |
|||||||||||||
(1)F元素处于周期表中周期族。
以下请用元素符号或化学式填空:
(2)原子半径最大的是, A分别与E、F、G、H形成的化合物中,最稳定的化合物是。
(3)最高价氧化物是两性氧化物的是,最高价氧化物对应的水化物碱性最强的是,最高价氧化物对应水化物的酸性最强的是。
(4)C与H形成的化合物中含有(填“共价”或“离子”)键;用电子式表示C、H形成化合物的过程。