为扩大现有资源的使用效率,在一些油品中加入降凝剂J,以降低其凝固点,从而扩大燃料油品的使用范围。下面是J的合成路线及L的性质图示: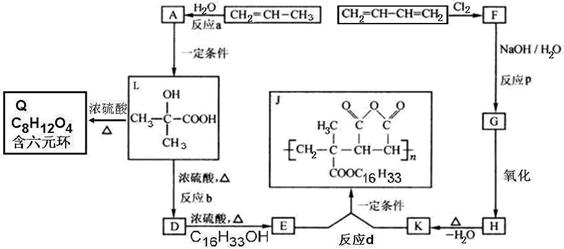
试回答下列问题:
(1)分别写出反应b和d的反应类型:b______________;d______________。
(2)分别写出E和H结构简式:E__________________;H__________________。
(3)写出化学方程式:F→G______________________;L→Q______________________。
(4)L在一定条件下可以生成一种高分子化合物M,写出此反应的化学方程式:_____________________。
(5)D的同分异构体中,能使Br2的CCl4溶液褪色,并能发生水解反应和银镜反应的有__________种,其中在核磁共振氢谱中出现四组峰,且峰面积之比为2:2:1:1的是__________________(写出结构简式)。
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为________。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是________(写化学式),非金属气态氢化物还原性最强的是________(写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有________(写出其中两种物质的化学式)。
(4)X2M的燃烧热ΔH=-a kJ·mol-1,写出X2M燃烧反应的热化学方程式:___________________________________________________________________。
(5)ZX的电子式为________;ZX与水反应放出气体的化学方程式为________。
(6)熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为: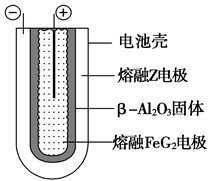
2Z+FeG2 Fe+2ZG放电时,电池的正极反应式为________;充电时,______(写物质名称)电极接电源的负极;该电池的电解质为________。
Fe+2ZG放电时,电池的正极反应式为________;充电时,______(写物质名称)电极接电源的负极;该电池的电解质为________。
磁材氧化铁的化学名称是氧化铁(Fe2O3),它是电子、电信工业的磁性材料,工业上采用生产钛白粉的下脚料(含大量FeSO4的废液)为原料来制备磁材氧化铁。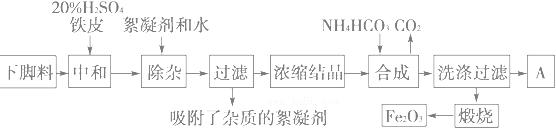
已知煅烧中的化学反应方程式为:FeCO3===FeO+CO2↑,4FeO+O2==2Fe2O3
(1)浓缩结晶后得到的晶体是________(填化学式),A中溶质是________;此溶液中各离子的浓度大小顺序为:________。
(2)20% H2SO4和铁皮的作用分别是_________。
(3)写出步骤“合成”中发生的化学变化(用化学方程式表示):_______________________。
A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子化合物;B与Z的最外层电子数之比为2︰3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红。请回答下列问题。
(1)X在周期表中的位置是_____________________________。
(2)化合物Y2X2的电子式为;它含有的化学键类型有(填序号)。
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应生成Z的化学方程式为__________________________________________________________________。
(4)A的单质与X的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则负极电极反应式为___________________
(5)写出化合物Y2X2与水反应的离子方程式________________________________________。
(6)B的最高价氧化物的结构式为_______________________________________________。
下表是元素周期表的一部分,请回答有关问题:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||
| 4 |
⑨ |
⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为_______________。
(2)表中能形成两性氢氧化物的元素是______(填元素名称),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式__________________________________________________。
(3)①、④、⑤、⑥、⑦、⑨六种元素的最高价氧化物的水化物中,按碱性减弱酸性增强的顺序排列为______________________________________(用化学式表示)。
(4)③元素与⑩元素两者核电荷数之差是__________。
(5)请写出②的氢化物发生催化氧化的化学方程式________________。
(6)请写出⑤元素的最高价氧化物的水化物与⑦元素的最高价氧化物的水化物反应的离子方程式。
烷烃A在同温同压下蒸气的密度是H2的50倍的烷烃分子式,甲烷的电子式,二氯甲烷的结构式, 写出CH3(CH2)5CH3 的名称:。戊烷三种同分异构体的结构简式:____________________________________________________________________________________________________________________。