现有下列四种物质:① Cl2、②NH3、③ NaHCO3、④FeCl3溶液。其中,与HCl相遇,有白烟产生的是 (填序号,下同),能与水反应,其水溶液有杀菌消毒作用的是 ,受热易分解,能与盐酸反应产生气体的是 ,遇KSCN溶液变为红色溶液的是 。
[《物质结构与性质》选考题]现代世界产量最高的金属是Fe、Al、Cu.
(1)Fe、Al、Cu三种元素第一电离能由高到低的排序为 ;Fe2+的电子排布式为 。
(2)Cu(OH)2溶于浓氨水形成 色铜氨溶液;乙二酸( )分子中碳原子杂化类型为 ,分子中σ键比π键多 个。
)分子中碳原子杂化类型为 ,分子中σ键比π键多 个。
(3)以下变化伴随化学键破坏的是 (填下列选项标号)
| A.冰融化 | B.铝气化 | C.AlCl3溶于水 | D.胆矾受热变白 |
(4)二氧化硅晶体结构示意图如下,每个氧原子最近且等距离相邻 个氧原子。
以天然气为原料合成氨是当下主流合成氨方式,其过程简示如下:
(1)甲烷脱硫的主要目的是 。
(2)甲烷一次转化发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)  。在20L的密闭容器中充入CH4(g)、H2O(g)各1mol,CH4的平衡转化率与温度、压强的关系如图。压强P1 (选填>、<、=)P2;若3min后在150℃、压强为P2时达到平衡,平均反应速率v(H2)= 。
。在20L的密闭容器中充入CH4(g)、H2O(g)各1mol,CH4的平衡转化率与温度、压强的关系如图。压强P1 (选填>、<、=)P2;若3min后在150℃、压强为P2时达到平衡,平均反应速率v(H2)= 。
(3)传统的化学脱碳法是用热碳酸钾溶液洗气,用什么方法可以使洗气后的碳酸钾溶液再生以循环使用? 。
铜洗能较彻底脱碳脱硫。醋酸亚铜溶于过量氨水形成的铜洗液,可吸收H2S、O2、CO、CO2等,该铜洗液吸收CO2的化学方程式: 。
(4)n(N2):n(H2)="1" : 3原料气进入合成塔,控制反应条件之外采取什么措施提高原料气利用率? 。
(5)NaCl、NaBr、NaI混合溶液中滴入AgNO3溶液至c(Ag+)=0.07 mol·L-1,溶液中浓度比
c(Cl-):c(Br-):c(I-)= : :1。
| AgCl |
AgBr |
AgI |
|
| Ksp |
2×10-10 |
5×10-13 |
1×10-16 |
X、Y、Z、W是原子序数依次增大的短周期元素,X元素的族序数是周期序数的2倍;Y的单质在空气中燃烧生成一种淡黄色的固体;Z元素最高化合价与最低化合价绝对值之差等于4;W元素在周期表中位于非金属性最强的元素下方。请回答:
(1)X元素在周期表中的位置是 ;W-离子的结构示意图为 。
(2)X元素可形成多种气态氢化物,其中相对分子质量为26的气态氢化物的电子式为 ;25℃、101kPa时该气态氢化物热值为5×104kJ•kg-1,则其标准燃烧热为 。
(3)写出一种适宜实验室制取W单质的离子方程式: 。
(4)室温时金即可溶于王水(浓盐酸和浓硝酸混合物)生成HAuCl4,若反应过程中消耗的氧化剂与还原剂物质的量相等,则该化学方程式为 。
市售一次电池品种很多,碱性锌锰电池在日常生活中用量很大。回收废旧锌锰电池并进行重新处理,可以获得MnO2及其他副产品,其工艺流程如下:
已知:“锰粉”的主要成分有MnO2、Zn(OH)2、MnOOH、碳粉,还含有少量铁盐和亚铁盐。常温下,生成氢氧化物沉淀的pH如下表:
| 物质 |
Fe(OH)3 |
Fe(OH)2 |
Zn(OH)2 |
Mn(OH)2 / Mn(OH)3 |
| 开始沉淀pH |
2.7 |
7.6 |
5.7 |
8.3 |
| 完全沉淀pH (c≤1.0×10-5mol/L) |
3.7 |
9.6 |
8.0 |
8.8 |
(1)加入NaOH溶液调节pH=8.0,目的是______________________________;计算常温下Zn(OH)2的溶度积常数Ksp[Zn(OH)2]=____________________。
(2)写出滤液2中的Mn2+变成MnO2的离子方程式_______________________________。
(3)写出滤渣B与稀硫酸在pH=5时反应的化学方程式______________________________。
(4)工艺中还可以将滤液4进行_____________、_____________、_____________、洗涤得到含结晶水的硫酸盐晶体。
(5)MnO2常用来制取KMnO4。在一定条件下将MnO2氧化为K2MnO4,然后用铁作阴极、铂作阳极电解K2MnO4溶液得到KMnO4。电解K2MnO4溶液的总反应方程式为______________________。
氮气化学性质很稳定,可以通过氮的固定将空气中的氮气转化氮的化合物。氮的化合物可用于进一步合成化肥、炸药以及合成树脂等。
(1)写出氮分子的电子式______________。
(2)人工合成氨反应为N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol,在一定条件下的恒容密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是________(填序号)。
2NH3(g) △H=-92.4kJ/mol,在一定条件下的恒容密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是________(填序号)。
| A.分离出NH3 |
| B.加入催化剂 |
| C.升高温度 |
| D.增加N2的浓度 |
E.增加H2的浓度
(3)氨的接触氧化制取硝酸的过程中,900℃时,氨氧化反应阶段可能发生的反应有
| 编号 |
热化学方程式 |
平衡常数 |
| Ⅰ |
4NH3(g)+5O2(g) 4NO(g)+6H2O (g) △H1 4NO(g)+6H2O (g) △H1 |
K1=1×1053 |
| Ⅱ |
4NH3(g)+3O2(g) 2N2(g)+6H2O (g) △H2 2N2(g)+6H2O (g) △H2 |
K2=1×1065 |
| Ⅲ |
2NO(g) N2(g)+O2(g) △H3 N2(g)+O2(g) △H3 |
K3 |
反应Ⅲ的△H3=____________(用△H1、△H2表示);反应Ⅱ的平衡常数的表达式K2=__________;
该温度下K3的计算结果为__________。
(4)催化反硝法可用于治理水中硝酸盐的污染。催化反硝法中,H2能将NO3-还原为N2。25℃时,反应进行10min,溶液的pH由7变为12。反应的离子方程式为____________________________;其平均反应速率为v(NO3-)______________mol/(L•min)。
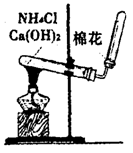
(5)实验室用下图所示装置制取NH3。若将收集NH3的试管改为集气瓶且瓶口向上排空气法收集NH3,并确保不污染环境,请画出其气体收集装置和尾气吸收装置,标出所用试剂(自选)名称。