(10分)下图是某温度下,在2L容器中某可逆反应X、Y、Z三种物质的浓度与时间的关系图,根据图中信息回答下列问题: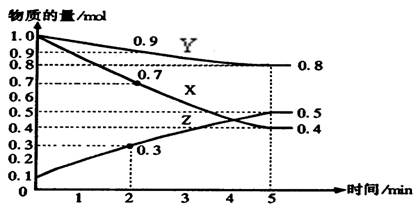
(1)由图中的数据分析,该反应的化学方程式为 ;
(2)用X表示的化学反应速率为 mol/(L·min),如果升高温度,达到平衡时的时间会变 (填长、短、不能确定或不变)
(3)5min后Z的生成速率 5min时Z的生成速率(填大于、小于或等于)。
(4)达到平衡时X的转化率为 ;
铝和氢氧化钾都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是 。
(2)铝与氢氧化钾溶液反应的离子方程式是 。
(3)工业品氢氧化钾的溶液中含有某些含氧酸杂质,可用离子交换膜法电解提纯。
电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。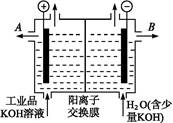
①该电解槽的阳极反应式是 。
②通电开始后,阴极附近溶液pH会增大,请简述原因 。
③除去杂质后的氢氧化钾溶液从溶液出口 (填写“A”或“B”)导出。
如图为持续电解含有一定量CaCl2水溶液(含酚酞)的装置(以铂为电极),A为电流表。电解一段时间t1后,将CO2连续通入电解液中。
(1)电解时,F极发生 反应,电极反应为 ,E极发生 反应,电极反应为 ,电解总反应为 。
(2)电解池中产生的现象:
① _____________________
② _____________________
③ _____________________
可以将氧化还原反应2H2+O2 2H2O设计成原电池。
2H2O设计成原电池。
(1)利用氢气和氧气、氢氧化钾溶液构成燃料电池,则负极通的气体应是 ,正极通的气体就是 ,电极反应为:正极 ,负极 。
(2)如果把KOH改为稀硫酸作电解质,则电极反应为:正极: ,负极: 。
(3)(1)和(2)的电解质溶液不同,反应进行后,其溶液的pH各有何变化? 。
(4)如把H2改为甲烷,KOH溶液作电解质溶液,则电极反应为:正极: ,负极: 。
铅蓄电池是典型的可充型电池,电池总反应为:Pb+PbO2+4H++2S 2PbSO4+2H2O。
2PbSO4+2H2O。
请回答下列问题(不考虑氢、氧的氧化还原):
放电时,正极的电极反应是 ;电解液中H2SO4的浓度将变 ;当外电路通过1 mol电子时,理论上负极板的质量增加 g。
化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)目前常用的镍镉(Ni Cd)电池,其电池总反应可以表示为:
Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是( )
①以上反应是可逆反应
②以上反应不是可逆反应
③充电时化学能转变为电能
④放电时化学能转变为电能
| A.①③ | B.②④ | C.①④ | D.②③ |
(2)废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍镉电池可以使一平方米面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重。这是因为 。