(1) 按系统命名法命名
①有机物CH3CH(C2H5)CH(CH3)2的名称是________________________。
②在有机物分子中若某一个碳原子连接4个不同的原子或基团,则这种碳原子称为“手性碳原子”。C7H16的同分异构体中具有“手性碳原子”的有三种,名称分别为________________ ________________ ________________ 。
(2) 写出下列各有机物的结构简式
① 2,3-二甲基-4-乙基已烷 _____________________________________
②支链只有一个乙基且式量最小的烷烃_____________________________
某化合物的分子式为C5H11Cl,分析数据表明:分子中含有两个—CH3,两个—CH2—,一个CH和一个 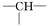 ,写出它可能的结构简式 ______________________
,写出它可能的结构简式 ______________________
已知下列有机物:
①CH3—CH2—CH2—CH3和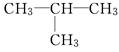
②CH2===CH—CH2—CH3和CH3—CH===CH—CH3
③CH3—CH2—OH和CH3—O—CH3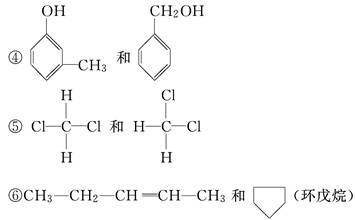
⑦CH2===CH—CH===CH2和CH3—CH2—C≡CH
(1)其中属于同分异构体的是________________.
(2)其中属于碳链异构的是________________.
(3)其中属于位置异构的是________________.
(4)其中属于官能团异构的是________________.
(5)其中属于同一种物质的是________________.
今有化合物: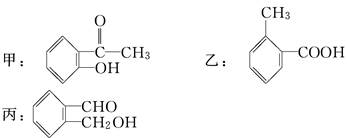
(1)请写出丙中含氧官能团的名称________.
(2)上述化合物中互为同分异构体的是________.
某学生写出如下十种一氯戊烷的同分异构体: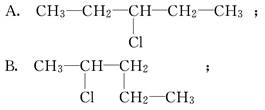
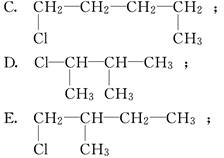
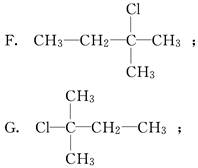
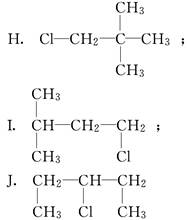
(1)你认为一氯戊烷共有________种同分异构体.
(2)上述十种结构中,属于同种分子的是______________________(填序号).
下列是一个化工产品生产过程设计框图,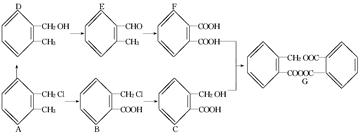
根据要求回答下列各题.
(1)只含有一种官能团的物质是________.
(2)含有羧基的是____________.
(3)写出G物质的分子式____________.