X、Y、Z为三种常见的单质,Z是绿色植物光合作用产物之一,A、B为常见化合物。它们在一定条件下可发生如图所示的反应(均在非溶液中进行)。
(1)当X为金属、Y为非金属时,A是________(填名称)。
(2)当X为非金属、Y为金属时,X可能是_________或________(均填化学式)。
(3)当X与Y均为金属时,X与A反应的化学方程式是______________________________。
(4)当X与Y均为非金属,且
X与Y同主族,X与A反应的化学方程式______________________________________。
X与Y不在同一主族,X与A反应的化学方程式________________________________。
(7分)在H+、Mg2+、Fe2+、Fe3+、S2-、I-、S中,只有氧化性的是____________,只有还原性的是 ________,既有氧化性又有还原性的是___________。
________,既有氧化性又有还原性的是___________。
下图中A、B、C、D、E、F、G均为有机化合物。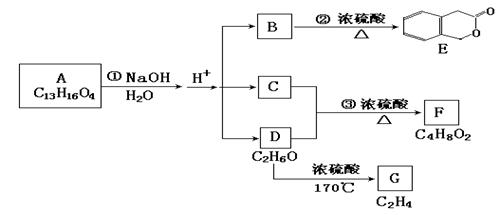
⑴ D的化学名称是。
⑵ 反应③的化学方程式是:。
⑶ B的分子式是,
A的结构简式是: 
反应①的反应类型是。
⑷符合下列三个条件的B的同分异构体的数目有个。
①含有邻二取代苯环结构;②与B具有相同的官能团;③不可与FeCl3溶液发生显色反应。写出其中所有同分异构体的结构简式(如果答题纸上的空格不够,请自己补填完整):
⑸G是重要的工业原料,用化学方程式表示G的一种重要工业用途
。
黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:SO2 + 2Fe3+ + 2H2O =SO42-+ 2Fe2++ 4H+
Cr2O72-+ 6 Fe2+ + 14 H+="2" Cr3+ + 6 Fe3+ + 7 H2O
⑴①黄铁矿煅烧的化学方程式为: 。
②样品中FeS2的质量分数是(假设杂质不参加反应)________________。
⑵若灼烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03 kJ热量,写出SO3气体转化为H2SO4的热化学方程式: ________________ ___________________________。
___________________________。
⑶煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为_____________L,制得98%的 硫酸质量为_________ t ,SO2全部转化为H2SO4时放出的热量是kJ。
硫酸质量为_________ t ,SO2全部转化为H2SO4时放出的热量是kJ。
(4)硫酸的用途非常广泛,请写出用之制取“普钙”的化学方程式并用最简洁的语言解释为什么这种化肥不能与草木灰混合施用: ;
、 。
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将(1)中的反应设计成原电池,请下面的框图中画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应: ,
负极反应: 。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:
。
| 氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
| Fe3+ Fe2+ Cu2+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
| 提供的药品: Cl2 浓H2SO4 溶液NaOH CuO Cu |
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式 、
劣质不锈钢腐蚀的实验现象: 
U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。请回答下列问题:
⑴V的单质分子的结构式为_______________;XW的电子式为____________;
Z元素在周期表中的位置是 。
⑵U元素形成的同素异形体的晶体类型可能是(填序号)__________。
① 原子晶体 ② 离子晶体 ③ 分子晶体 ④ 金属晶体
⑶U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)____________;V、W的氢化物分子结合H+能力较强的是(写化学式)______________,用一个离子方程式加以证明:_______________________________。
⑷YW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为:__________________________________________,由此可知VW和YW2还原性较强的是(写化学式)______________________________。