已知某溶液中只存在OH一、H+、NH4+、Cl一四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Cl一)>c(NH4+)> c(H+)> c(OH-)
②c(Cl一) >c(NH4+)> c(OH-)> c(H+)
③c(NH4+)>c(Cl一)> c(OH-)> c(H+)
④ c(Cl一) >c(H+)> c(NH4+)> c(OH-)
填写下列空白:
(1)由若溶液中只溶解了一种溶质,则该溶质是__________,上述四种离子浓度的大小顺序符合___________(填序号)
(2)若溶解两种溶质,上述关系中③是正确的,则溶液中的溶质为____________________;
若溶解两种溶质,上述关系中④是正确的,则溶液中的溶质为____________________。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)___________c(NH3·H2O)(填“大于”、“小于”或“等于” 下同),混合前酸中c(H+)和碱中c(OH-)的关系:c(H+)____________ c(OH-)。
阿斯匹林(aspirin)的有效成分是乙酰水杨酸,它是19世纪末合成成功的,作为一个有效的解热止痛、治疗感冒的药物,至今仍广泛使用,有关报道表明,人们正在发现它的某些新功能。阿斯匹林是由水杨酸(邻羟基苯甲酸)与乙酸酐进行酯化反应而得的。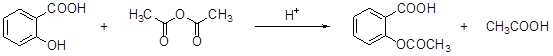
水杨酸乙酸酐乙酰水杨酸
(1)乙酰水杨酸的含氧官能团分别是和酯基。
(2)乙酰水杨酸不应具有的性质()
| A.与NaOH溶液反应 | B.与金属钠反应 |
| C.与乙酸发生酯化反应 | D.与乙醇发生酯化反应 |
(3)写出乙酰水杨酸与稀酸溶液共热的化学方程式:
(4)为测定阿斯匹林中有效成分的含量,称取样品0.250 0 g ,准确加入浓度为0.1015 mol·L- NaOH溶液50.00 mL,煮沸60min。冷却后用浓度为0.1015 mol·L-1的HC1溶液返滴过量的NaOH,消耗HC1溶液记录如下:
| 次数 数据 |
1 |
2 |
3 |
| 初始读数 |
2.00 |
12.50 |
5.20 |
| 最后读数 |
27.10 |
37.40 |
33.20 |
则该产品中乙酰水杨酸的含量为(乙酰水杨酸的摩尔质量是180.16 g·mol-1) 。(只要求列式表示,不计算出最后结果)。
A、B、C是大家熟悉的与生命活动密切相关的三种化合物,它们所含元素不超过三种,并有下列转化关系:
其中化合物D也是日常生活中常见的化合物,在一定条件下可与单质甲进一步发生如下变化:

回答下列有关问题
(1)在A、B、C、D四种化合中,所含元素相同的是(写物质名称)________、________。
(2)常温下,A和B是通过什么途径转化为C的?____________________________。
(3)目前,化合物B在自然界中的含量呈上升趋势,对环境产生了不良影响,发生这种变化的主要原因是______________________________________________。
维生素C的结构简式如下图,它的分子式是______________。由于它能防治坏血病,又称为_________________。在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有__________性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是______________,说明维生素C具有_________性。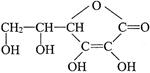
下表是某食品包装袋上的说明,从表中的配料中分别选出一种物质填在相应的横线上。
| 品 名 |
浓缩菠萝汁 |
| 配 料 |
水.浓缩菠萝汁.蔗糖.柠檬酸.黄原胶.甜蜜素.维生素C,菠萝香精.柠檬黄.日落黄.山梨酸钾等 |
| 果汁含量 |
≥80% |
| 生产日期 |
标于包装袋封口上 |
其中属于着色剂的有属于调味剂的有
属于防腐剂的有富含维生素的有.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数的测定。将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)△H =" a" kJ/mol
2NH3(g)+CO2(g)△H =" a" kJ/mol
实验测得不同温度下的平衡数据列于下表:
| 温度/℃ |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡总压强/kPa |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
| 平衡气体总浓度/mol·L-1 |
2.4×10-3 |
3.4×10-3 |
4.8×10-3 |
6.8×10-3 |
9.4×10-3 |
①取一定量的氨基甲酸铵固体放在一个100L的密闭真空容器中,在25.0 ℃达到分解平衡。则反应热(填“吸”或“放”)kJ/mol(用含a字母表示)。若将温度降到15.0 ℃,再次达平衡后氨基甲酸铵固体改变g
②根据表中数据,列式计算25.0 ℃时的分解平衡常数:.