25℃时,几种弱酸的电离常数如下:
| 弱酸化学式 |
CH3COOH |
HCN |
H2S |
| 电离常数(25℃) |
1.8×10-5 |
4.9×10-10 |
K1= 1.3×10-7 K2= 7.1×10-15 |
25℃时,下列说法正确的是
| A.等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) |
| B. a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)> c(CN-),则a一定大于b |
| C. NaHS和Na2S混合溶液中,一定存在c(Na+)+ c(H+)="=" c(OH-)+ c(HS-)+2c(S2-) |
| D.某浓度HCN的水溶液pH=d,则其中c(OH-)=10-d mol/L |
25℃时,在0.1 mol·L-1的下列溶液中,微粒的物质的量浓度关系正确的是
| A.NH4Cl溶液中:c(NH4+)>c(Cl—)>c(H+)>c(OH-) |
B.NaHSO3溶液(呈酸性)中:c(Na+)>c(HSO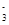 )>c(SO )>c(SO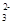 )>c(H2SO3) )>c(H2SO3) |
| C.CH3COONa溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
D.Na2CO3溶液中:2c(Na+)=c(CO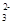 )+ c(HCO )+ c(HCO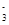 )+c(H2CO3) )+c(H2CO3) |
下列叙述正确的是
| A.将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO42-)= c(NH4+) |
| B.pH = 3的醋酸溶液,稀释至10倍后pH = 4 |
| C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,溶液pH<7 |
| D.向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-) 减小 |
一定条件下在固定体积的密闭容器中,能表示反应X(g)+2Y(g) 2Z(g)一定达到化学平衡状态的是
2Z(g)一定达到化学平衡状态的是
| A.X、Y、Z的物质的量之比为1∶2∶2 |
| B.X、Y、Z的浓度不再发生变化 |
| C.容器中的压强不再发生变化 |
| D.单位时间内生成n mol Z,同时生成2n mol Y |
将 4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)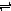 2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol•L-1,
2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol•L-1,
现有下列正确的是
| A.用物质 B 表示的反应的平均速率为 0.6 mol•L-1•s-1 |
| B.2 s 时物质 B 的浓度为 0.7 mol•L-1 |
| C.2 s 时物质 A 的转化率为70% |
| D.用物质 A 表示的反应的平均速率为 0.3 mol•L-1•s-1 |
下列有关防护金属腐蚀的说法中,不正确的是
| A.青铜(锡铜合金)中的锡可对铜起保护作用 |
| B.在海轮外壳上焊接上锌块,可减缓船体的腐蚀速率 |
| C.钢铁表面烤蓝生成一层致密的Fe3O4,能起到防腐蚀的作用 |
| D.海水中钢闸门与电源的正极相连,可以防止闸门的腐蚀 |