2009年10月1日,我国成功举办国庆六十年阅兵活动。其中阅兵仪式上9辆电 动车与混合动力车等新能源车辆的亮相,展示了综合国力、国防科技发展水平。同时也说明能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
动车与混合动力车等新能源车辆的亮相,展示了综合国力、国防科技发展水平。同时也说明能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合 成甲醇:
成甲醇:
反应Ⅰ: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)  ΔH2
ΔH2
①上述反应符合“原子经济”原则的是 (填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度[ |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O (g) ΔH1=-1275.6 kJ/mol
(g) ΔH1=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH3=-44.0 kJ/mol
H2O(g) = H2O(l) ΔH3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(3)某实验小组依据甲醇燃烧的反应原理,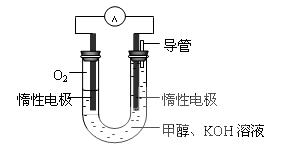
①设计如图所示的电池 装置。该电池正极的电极反应为 。
装置。该电池正极的电极反应为 。
②工作一段时间后,测得溶液的pH减小,该电池总 反应的离子方程式为
反应的离子方程式为
。
(5分)对于混合物的分离或提纯,常采用的方法有:①过滤,②蒸发,③蒸馏,④萃取,⑤加热分解等。下列各组混合物的分离或提纯应采用什么方法?(要求:填序号)
(1)实验室中的石灰水久置,液面上常悬浮有CaCO3微粒。可用________的方法除去Ca(OH)2溶液中悬浮的CaCO3微粒。
(2)提取碘水中的碘,用________方法。
(3)除去食盐溶液中的水,可采用________的方法。
(4)淡化食盐水,可采用______的方法。 (5)除去氧化钙中的碳酸钙可用______的方法。
(7分)(1)1.5molH2SO4的质量是______,其中含有____mol H。
(2)3.6gH2O的物质的量是,含有H2O个。
(3)9.03×1023个氨分子含________摩尔氨分子。
(4)某化学兴趣小组对“农夫山泉”矿泉水进行检测时,发现1.0 L该矿泉水中含有45.6 mg Mg2+,则该矿泉水中Mg2+的物质的量浓度为。
(5)从1L 1mol/LNaOH溶液中取出100mL,则这100mLNaOH溶液中含NaOH的质量g。
对于混合物的分离或提纯,常采用的方法有: ①过滤、 ②蒸发结晶、趁热过滤、 ③蒸馏、 ④萃取、 ⑤洗气、 ⑥加热分解、⑦分液、⑧蒸发浓缩、冷却结晶等。 选用合适的方法序号分离或提纯下列各组混和物。
(1)实验室中的石灰水久置,液面上常悬浮有CaCO3微粒。可用的方法除去Ca(OH)2溶液中悬浮的CaCO3微粒。
(2)除去H2中的CO2,可用的方法除去。
(3)用四氯化碳提取碘水中碘可用_________的方法。
(4)除去氧化钙中的碳酸钙可用的方法。
(5)分离植物油和水可用________________的方法。
(6)除去NaCl中混有的少量KNO3可用的方法。
有以下几种物质: ① 干燥的食盐晶体 ②乙醇 ③水银 ④蔗糖 ⑤冰醋酸(纯醋酸晶体) ⑥ KNO3溶液 ⑦氨水 ⑧BaSO4 ⑨NH4HCO3。 填空回答(填序号):
(1)以上物质可以导电的是;
(2)以上物质中属于电解质的是;
(3)以上物质中属于非电解质的是;
(4)以上物质中只有在水溶液中才能导电的电解质是。
(1)5.3gNa2CO3的物质的量是,约含有Na+个。
(2)同温同压下的氮气和氢气,若体积相同时,两种气体的质量比,其密度比为;若质量相等时,两种气体的体积比为。
(3)相同物质的量浓度、相同体积的NaCl、MgCl2、AlCl3溶液,分别与足量的AgNO3溶液反应,生成AgCl沉淀的质量之比为________。
(4)相同物质的量浓度的NaCl、MgCl2、AlCl3溶液,分别与足量的AgNO3溶液反应,当生成的AgCl质量相同时,消耗的三种溶液的体积比为________。
(5)相同浓度的NaCl、MgCl2、AlCl3溶液,分别与AgNO3溶液反应,当生成的AgCl沉淀的质量之比为3∶2∶1时,三种溶液的体积比为________。