(7分)(1)1.5molH2SO4的质量是______,其中含有___ _mol H。
(2)3.6gH2O的物质的量是 ,含有H2O 个。
(3)9.03×1023个氨分子含________摩尔氨分子。
(4)某化学兴趣小组对“农夫山泉”矿泉水进行检测时,发现1.0 L该矿泉水中含有45.6 mg Mg2+,则该矿泉水中Mg2+的物质的量浓度为 。
(5)从1L 1mol/LNaOH溶液中取出100mL,则这100mLNaOH溶液中含NaOH的质量 g。
反应A(g)+ B(g) C(g) +2D(g)的能量变化如下图所示,回答下列问题。
C(g) +2D(g)的能量变化如下图所示,回答下列问题。
(1)该反应是 反应(填“吸热”“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率 (填“增大”“减小”“不变”下同),原因是 ;
(3)向体系中加入催化剂,△H ;
(4)将1molA和2molB加入2L容器中,5min后达到平衡,此时A的转化率为50%,则5min内用D表示化学反应速率为 ,平衡常数K= 。
可逆反应:aA(g)+ bB(g) cC(g)+ dD(g);根据图回答:
cC(g)+ dD(g);根据图回答:
(1)压强P1比P2 (填大或小);
(2)(a +b)比(c +d) (填大或小);
(3)温度t1℃比t2℃ (填高或低);
(4)正反应为 反应。
(1)FeCl3溶液呈________(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):_______________________;实验室在配制FeCl3溶液时,常将FeCl3固体先溶于较浓的盐酸中,_____________(填“促进”、“抑制”)其水解,然后再用蒸馏水稀释到所需的浓度。
(2)将氯化铝溶液蒸干灼烧得到的固体物质是 ;(填化学式,下同)将硫酸铝溶液蒸干得到的固体物质是 。
如下图所示: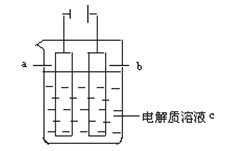
(1)a电极是_________(填“阴极”或“阳极”),b电极是_________(填“阴极”或“阳极”)。
(2)当电解NaCl溶液时:
①a电极的电极反应为________________,该反应是_______(填“氧化”或“还原”)反应;
②b电极的电极反应为______________,该反应是_________(填“氧化”或“还原”)反应。
(3)当电解精炼铜时:
①a电极是__________(填“粗铜”或“纯铜”),其电极反应为__________________________;
②b电极是__________(填“粗铜”或“纯铜”),其电极反应为__________________________。
用铜、锌和硫酸铜溶液设计一个原电池。
原电池的负极是 ,电极反应式是 ;
正极是 ,电极反应式是 。