某气态烃A在标准状况下的密度为1.25g/L,其产量可以用来衡量一个国家的石油化工发展水平。B和D都是生活中常见的有机物,D能跟碳酸氢钠反应,F有香味。它们之间的转化关系如下图所示:



 (1)A的结构式为 ,B中官能团的电子式为 ,
(1)A的结构式为 ,B中官能团的电子式为 ,
 D中官能团的名称为 。
D中官能团的名称为 。
 (2)反应①的反应类型是 ,
(2)反应①的反应类型是 ,
反应③的化学方程式为 。
。


 (3)反应②在Cu做催化剂的条件下进行,该实验的步骤是将红亮的铜丝置于酒精灯上加热,待铜丝变为黑色时,迅速将其插入到装有B的试管中(如图所示)。重复操作2-3次,观察到的现象是 。该反应的化学方程式为 。
(3)反应②在Cu做催化剂的条件下进行,该实验的步骤是将红亮的铜丝置于酒精灯上加热,待铜丝变为黑色时,迅速将其插入到装有B的试管中(如图所示)。重复操作2-3次,观察到的现象是 。该反应的化学方程式为 。
 (4)D与碳酸氢钠溶液反应的离子方程式为 。
(4)D与碳酸氢钠溶液反应的离子方程式为 。
 (5)B、D在浓硫酸的作用下实现反应④,实验装置如下图所示:
(5)B、D在浓硫酸的作用下实现反应④,实验装置如下图所示:

 试管1中装药品的顺序为先取 (填“B”、“D”、“浓硫酸”,下同),再加入 ,最后加入 。图中X的化学式为 。
试管1中装药品的顺序为先取 (填“B”、“D”、“浓硫酸”,下同),再加入 ,最后加入 。图中X的化学式为 。
 浓硫酸的作用是 。
浓硫酸的作用是 。
 该反应的化学方程式为 。
该反应的化学方程式为 。
某化学课外小组用下图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
(1)写出A中反应的化学方程式______________________。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是________________,写出有关的化学方程式__________________________________。
(3)C中盛放CCl4的作用是__________________。
(4)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入________,现象是______________。
把1 mol CH4和一定量Cl2组成的混合气体通入大试管中,将此试管倒立在盛有饱和食盐水的水槽中,放在光亮处,回答下列问题:
(1)片刻后试管中的现象为:①试管内气体的颜色变浅,②试管壁上出现 、③试管内 。
(2)在反应结束后,试管内的产物最多的是 ,空间构型呈正四面体的产物为 。
(3)若(2)中生成的四种有机产物的物质的量相同,则反应消耗的Cl2的物质的量为 。
下图为硬脂酸甘油酯在碱性条件下水解的装置图,进行皂化反应时的步骤如下:
(1)在圆底烧瓶中装入7~8 g硬脂酸甘油酯,然后加入2~3 g的氢氧化钠、5 mL水和10 mL酒精;加入酒精的作用为_______________________________。
(2)向所得混合物中加入_______,静置一段时间,溶液分为上下两层,肥皂在___层。
(3)图中长玻璃管的作用是________________________________________________。
(4)写出该反应的化学方程式______________________________________________。
某化学实验室产生的废液中含有Fe3+、Cu2+、Ba2+、Cl-四种离子,现设计下列方案对废液进行处理,以回收金属并制备氯化钡、氯化铁晶体。
(1)沉淀1中含有的金属单质是 。
(2)氧化时加入H2O2溶液发生反应的离子方程式为 。
(3)下列物质中,可以作为试剂X的是 (填字母)。
| A.BaCl2 | B.BaCO3 | C.NaOH | D.Ba(OH)2 |
(4)检验沉淀2洗涤是否完全的方法是 。
(5)制备氯化铁晶体过程中需保持盐酸过量,其目的是 。
(6)由过滤2得到的滤液制备BaCl2的实验操作依次为 、冷却结晶、 、洗涤、干燥。
(13分)Cr2O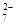 和CN-是工业废水中常见的污染物.若利用下列流程可对分别含两种离子的废水进行综合处理:
和CN-是工业废水中常见的污染物.若利用下列流程可对分别含两种离子的废水进行综合处理: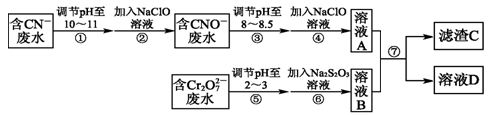
已知:Cr3+也有一定毒性,Cr3+在pH=6.0时开始沉淀,pH=8.0时沉淀完全.
回答下列问题:
(1)已知步骤②中无气体生成,写出反应的离子方程式______________________.
步骤④中NaClO可将CNO-处理为完全无害的溶液,该过程中有两种无毒的不支持燃烧的气体产生,写出这两种气体的化学式____________________________.
(2)步骤⑥的反应为S2O32-+Cr2O72-+H+―→SO42-+Cr3++H2O(未配平),则每处理1 mol Cr2O72-转移________mol电子.
(3)滤渣C的化学式为Cr(OH)3,溶液A和溶液B混合可使废水中的Cr3+沉淀的原因是______________________________________________________.
(4)步骤⑦的操作名称为___________,若该操作在实验室中进行,则所需的玻璃仪器为________.