A、B、C、D是四种常见的单质,A、B为金属,C、D常温下是气体,且D为黄绿色气体。甲、乙、丙为常见的化合物,甲是黑色且具有磁性的物质。它们之间的转化关系如下图所示:
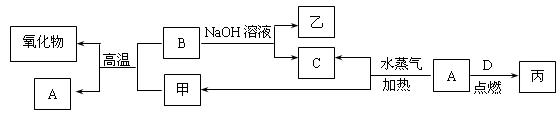

 请回答下列问题:
请回答下列问题: (1)B与甲反应的化学方程式是 。
(1)B与甲反应的化学方程式是 。 (2)常温下,将A或B的单质放入浓硫酸或浓硝酸中,是否溶解? (填“是”或“否”)。
(2)常温下,将A或B的单质放入浓硫酸或浓硝酸中,是否溶解? (填“是”或“否”)。



 (3)将丙溶于水配成溶液,检验丙中阳离子的方法是
(3)将丙溶于水配成溶液,检验丙中阳离子的方法是  。
。 (4)写出A与水蒸气反应生成C和甲的化学方程式 。
(4)写出A与水蒸气反应生成C和甲的化学方程式 。 (5)将A、B两种金属按一定的质量比组成混合物。
(5)将A、B两种金属按一定的质量比组成混合物。 ①取一定质量的该混合物,向其中加入足量的NaOH溶液,生成气体的体积在标准状况下为n L,B与NaOH溶液反应的离子方程式是 ,混合物中B的物质的量为 mol(用含字母的分数式表示)。
①取一定质量的该混合物,向其中加入足量的NaOH溶液,生成气体的体积在标准状况下为n L,B与NaOH溶液反应的离子方程式是 ,混合物中B的物质的量为 mol(用含字母的分数式表示)。 ②另取相同质量的该混合物,向其中加入足量的稀硫酸,固体全部溶解,生成气体的体积在标准状况下为m L,该反应中转移电子的物质的量为 mol,混合物中A的质量为 g(用含字母的分数式表示)。
②另取相同质量的该混合物,向其中加入足量的稀硫酸,固体全部溶解,生成气体的体积在标准状况下为m L,该反应中转移电子的物质的量为 mol,混合物中A的质量为 g(用含字母的分数式表示)。 ③向②所得的溶液中加入过量的氢氧化钠溶液,充分搅拌,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中铝的质量分数为 。
③向②所得的溶液中加入过量的氢氧化钠溶液,充分搅拌,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中铝的质量分数为 。

(15分)有机物G是一种食品香料,其香气强度为普通香料的3~4倍,有机物I的合成路线如下: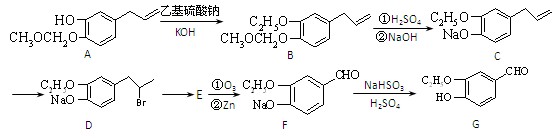
已知: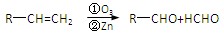
(1)该香料长期暴露于空气中易变质,其原因是。
(2)写出A中含氧官能团的名称:,由C到 D的反应类型为。
(3)有机物E的结构简式为。
(4)有机物G同时满足下列条件的同分异构体有种。
①与FeCl3溶液反应显紫色;
②可发生水解反应,其中一种水解产物能发生银镜反应;
③分子中有4种不同化学环境的氢。
(5)写出以 为原料制备
为原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
有机物丙(C13H18O2)是一种香料,其合成路线如图所示。其中A的相对分子质量通过质谱法测得为56,它的核磁共振氢谱显示只有三组峰;D可以发生银镜反应,在催化剂存在条件下1 mol D与2 mol H2反应可以生成乙;丙中含有两个-CH3

(1)A的结构简式为;乙的分子式为。
(2)C与新制Cu(OH)2悬浊液反应的化学方程式_________________。
(3)D所含官能团的名称是;D有多种同分异构体,其中与其所含官能团相同的同分异构体有种(不考虑立体异构)。
(4)甲与乙反应的化学方程式为。
(5)写出满足下列条件的有机物的结构简式ⅰ与乙互为同分异构体;ⅱ遇FeCl3溶液显紫色;ⅲ其苯环上的一溴代物只有两种。
Q、R、X、Y、Z为周期表中原子序数依次递增的前四周期元素。已知:
①Q为元素周期表中原子半径最小的元素;
②R的基态原子中电子占据三种能量不同的能级,且每种能级中的电子总数相同;
③Y的基态原子的核外成对电子数是未成对电子数的3倍;
④Q、R、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,Q、R两种元素组成的原子个数比为1:1的化合物N的质荷比最大值为78;
⑤Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同。
请回答下列问题(答题时,Q、R、X、Y、Z用所对应的元素符号表示)
(1)化合物M的空间构型为,其中心原子采取杂化;化合物N在固态时的晶体类型为。
(2)R、X、Y三种元素的第一电离能由小到大的顺序为。
(3)由上述一种或多种元素组成的与RY2互为等电子体的分子为(写分子式)。
(4)Z原子基态时的外围电子排布式为;Z的一种含氧酸钡盐的晶胞结构如图所示,晶体内与每个Z原子等距离且最近的氧原子数为。
(5)由R、X、Y三种元素组成的RXY-离子在酸性条件下可与NaClO溶液反应,生成X2、RY2等物质。该反应的离子方程式为。
运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义
(1)硫酸生产过程中2SO2(g)+O2(g) 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图所示,根据右图回答下列问题:
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图所示,根据右图回答下列问题:
①2SO2(g)+O2(g) 2SO3(g)的△H__________0(填“>”或“<”),
2SO3(g)的△H__________0(填“>”或“<”),
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是。
A体系的密度不发生变化B SO2与SO3的体积比保持不变
C体系中硫元素的质量百分含量不再变化D单位时间内转移4 mol 电子,同时消耗2 mol SO3
E.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g)  2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。 图1 图2图3
图1 图2图3
①该反应的平衡常数表达式为,升高温度,平衡常数(填“增大”或“减小”或“不变”)。
②由图2信息,计算0~10min内该反应的平均速率v(H2)=,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为(填“a”或“b”或“c”或“d”)
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1T2(填“>”或“=”或“<”)
(3)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈性,所得溶液中c(H+)- c(OH-)=(填写表达式)(已知:H2SO3:Ka1=1.7×10-2,Ka2=6.0×10-8,NH3·H2O:Kb=1.8×10-5)
(14分)尽管氮元素在地壳中的丰度较低(主要以硝酸盐的形式存在),在所有元素中仅排31位,但是大气中有丰富的氮气,这为氨和硝酸的广泛应用提供了可能。
(1)氮气的电子式为_______,雷电作用能进行氮的固定,写出反应方程式______________。
(2)食物蕴含的营养物质中,含氮的高分子化合物是______________ (填名称),其水解的最终产物为______________。
(3)土壤中的NH4+在硝化细菌的催化作用下可转化为NO3﹣,写出其离子方程式: ______________。
(4)某铜铝合金用足量稀硝酸完全溶解,得到标准状况下NO 11.2 L,再向溶液中加入过量氨水,充分反应后过滤。①滤液显深蓝色是因为含有的离子(填化学式).______________。②若沉淀质量为7.8g,则合金的质量为______________g。