用NA表示阿伏加德罗常数,下列叙述正确的是
| A.64g SO2含有氧原子数为1NA |
| B.物质的量浓度为0.5mol/L Mg Cl2溶液,含有Cl-离子数为1NA |
| C.标准状况下,22.4L H2O的分子数为1NA |
| D.常温常压下,14g N2含有分子数为0.5NA |
11P+15CuSO4+24H2O=5Cu2P+6H3PO4+15H2SO4中,2molCuSO4能氧化P的物质的量为()
| A.2/5mol | B.4/5mol | C.6/5mol | D.22/5mol |
常温下,下列各组离子在指定溶液中一定能大量共存的是()
| A.2.0mol/LKNO3溶液:H+、Fe2+、SCN-、SO42- |
| B.2.0mol/LNaAlO2溶液:Cl-、HCO3-、K+、ClO- |
| C.某澄清透明的溶液:Fe2+、SO42-、Mg2+、Cl- |
| D.c(C1O-)=2.0mol/L的溶液:Na+、I-、S2-、SO42- |
下列相关反应的离子方程式书写正确的是( )
| A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| B.Al片与少量NaOH溶液反应,产生气体:2Al+2OH-+2H2O=2Al(OH)3+3H2↑ |
C.向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH-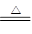 NH3·H2O NH3·H2O |
| D.用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O=2Mn2++5O2↑+8H2O |
如图表示ag O2与a gX气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是( )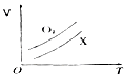
| A.C2H4(气) | B.CH4 | C.CO2 | D.NO |
实脸室取等物质的量的KClO3分别发生下述反应:
反应一:有催化剂存在时,受热分解得到氧气;
反应二:不使用催化剂,加热至743K左右,得到KClO4和KCl。
下列关子①和②的说法正确的是()
| A.两个反应中都只有一种元素化合价发生改变 |
| B.两个过程生成KCl的物质的量相同 |
| C.发生氧化反应的元素相同 |
| D.发生还原反应的元素相同 |