氯化钠样品含有少量的Na2SO4 和 Na2CO3,按下列流程进行净化,请在流程中的( )中写上合适的试剂,在[ ]中写上实验操作名称
写出有关反应的化学方程式:
第步②
第步③
第步⑤
多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子),制备BaCl2 • 2H2O,工艺流程如下:
已知: ① 常温下Fe3+、Mg2+ 完全沉淀的pH分别是3.4、12.4;
② BaCO3的相对分子质量是197; BaCl2 • 2H2O的相对分子质量是244;
(1)SiCl4发生水解反应的化学方程式__________________________________
(2)高温下,SiCl4 (g) 用H2还原可制取纯度很高的硅,当反应中有1mol电子转移时吸收
59 kJ热量,则该反应的热化学方程式为__________________________________
(3)加钡矿粉调节pH=7的作用是:
①使BaCO3转化为BaCl2②_______________________________
(4)生成滤渣A的离子方程式________________________________________
(5)BaCl2滤液经__________、_________、过滤、洗涤,再经真空干燥后得到BaCl2 • 2H2O
(6)10吨含78.8% BaCO3的钡矿粉理论上最多能生成BaCl2 • 2H2O___________吨。
下图是部分短周期元素的常见化合价与原子序数的关系图:
(1)元素A在周期表中的位置。
(2)用电子式表示D2G的形成过程,其所含化学键类型为。
(3)C2—、D+、G2—离子半径由大到小顺序是(用离子符号回答)。
(4)某同学设计实验证明A、B、F的非金属性强弱关系。
①溶液a和b分别为,。
②溶液c中的离子方程式为。
③请从原子结构的角度解释非金属性B>A的原因。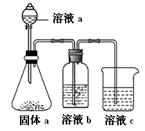
(5)将0.5 mol D2C2投入100 mL 3 mol/L ECl3溶液中:
①转移电子的物质的量为。
②用一个离子方程式表示该反应。
某溶液仅含下列离子中的5种(不考虑水的电离及离子的水解)且各种离子物质的量均为1 mol 。
阳离子:Na+、Mg2+、Fe3+、Al3+、Fe2+ ;阴离子:OH—、CO32—、Cl—、NO3—、SO42—。
①若向溶液中加入KSCN溶液无明显变化;
②若向原溶液中加入稀盐酸,有无色气体生成,溶液中阴离子种类不变; 请推断:
(1)原溶液中含有阳离子含有阴离子
(2)向原溶液中加入足量稀盐酸发生反应的离子方程式
(3)若向原溶液中加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体
质量为 g。
氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40 ℃~50 ℃时
反应可生成它。CuH不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+ 在酸
性条件下发生的反应是2Cu+ =Cu2++Cu。根据以上信息,结合自己所掌握的化学知识,回答:
(1)在CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中所起的作用是________________。
(2)写出CuH在氯气中燃烧的化学反应方程式_______________________________。
(3)CuH溶解在稀盐酸中生成的气体是___________,如果反应中生成了标准状况下22.4 L的气体,被还原的离子得电子的物质的量是________________。
下图中A、B、C、D、E、F、G均为有机化合物。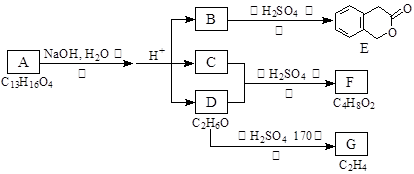
根据上图回答问题:
(1)D的化学名称是。
(2)反应③的化学方程式是 。(有机物须用结构简式表示)
(3)B的分子式是。A的结构简式是。反应①的反应类型是。
(4)符合下列3个条件的B的同分异构体的数目有个。
①含有邻二取代苯环结构、②与B有相同官能团、③不与FeCl3溶液发生显色反应。
写出其中任意一个同分异构体的结构简式。
(5)G是重要的工业原料,用化学方程式表示G的一种重要的工业用途。