随着人们生活质量的不断提高,废旧电池必须进行集中处理的问题被提到了政府的议事日程,其主要原因是 ( )
| A.回收废旧电池中的石墨电极材料 |
| B.防止电池中汞、镉和铅等重金属元素对土壤和水源的污染 |
| C.防止废旧电池中渗漏的电解液腐蚀其他物品 |
| D.回收废旧电池外壳的金属材料 |
可逆反应:3A(g) 3B(?)+C(?)(正反应是吸热反应),随着温度升高,气体平均相对分子质量有减小趋势,则下列判断正确的是( )
3B(?)+C(?)(正反应是吸热反应),随着温度升高,气体平均相对分子质量有减小趋势,则下列判断正确的是( )
| A.B和C可能都是固体 | B.B和C一定都是气体 |
| C.若C为固体,则B一定是气体 | D.B和C一定都是气体 |
如右图中的曲线是表示其他条件一定时,2NO+O2 2NO2(正反应是放热反应)反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是 ( )
2NO2(正反应是放热反应)反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是 ( )
| A.a | B.b | C.c | D.d |
在一个固定容积的密闭容器中,可发生以下反应:A(g)+B(g) xC(g)符合下图(a)所示的关系(W(C)表示C的体积分数),由此推断关于图(b)的说法正确的是
xC(g)符合下图(a)所示的关系(W(C)表示C的体积分数),由此推断关于图(b)的说法正确的是
A.P3>P4,y轴表示A的转化率B.P3<P4,y轴表示B的体积分数
C.P3<P4,y轴表示混合气体的平均相对分子质量D.P3>P4,y轴表示混合气体的密度
对于可逆反应A(g)+B(g) C(g) ΔH﹤0,图2-17中表示的生成物C的百分含量(C%)与时间t的关系正确的是( )
C(g) ΔH﹤0,图2-17中表示的生成物C的百分含量(C%)与时间t的关系正确的是( )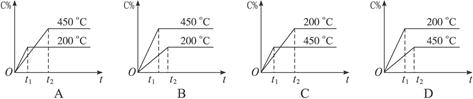
以NA代表阿伏伽德罗常数,则关于热化学方程式C2H2(g)+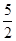 O2(g)===2CO2(g)+H2O(l) ΔH=-1300 kJ/mol的说法中,正确的是( )
O2(g)===2CO2(g)+H2O(l) ΔH=-1300 kJ/mol的说法中,正确的是( )
| A.当12NA个电子转移时,该反应放出1300 kJ的能量 |
| B.当1NA个水分子生成且为液体时,吸收1300 kJ的能量 |
| C.当有2NA个碳氧共用电子对生成时,放出1300 kJ的能量 |
| D.当有8NA个碳氧共用电子对生成时,放出1300 kJ的能量 |