现有如下四个图象:( )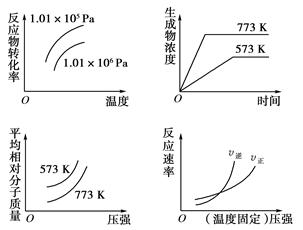
下列反应中全部符合上述图象的反应是( )
A.N2(g)+3H2(g)  2NH3(g)ΔH=-Q1 kJ/mol(Q1>0) 2NH3(g)ΔH=-Q1 kJ/mol(Q1>0) |
B.H2(g)+CO(g) C(s)+H2O(g)ΔH=+Q4 kJ/mol(Q4>0) C(s)+H2O(g)ΔH=+Q4 kJ/mol(Q4>0) |
C.4NH3(g)+5O2(g)  4NO(g)+6H2O(g)ΔH=-Q3 kJ/mol(Q3>0) 4NO(g)+6H2O(g)ΔH=-Q3 kJ/mol(Q3>0) |
D.2SO3(g) 2SO2(g)+O2(g)ΔH=+Q2 kJ/mol(Q2>0) 2SO2(g)+O2(g)ΔH=+Q2 kJ/mol(Q2>0) |
把500 mL NH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含a mol氢氧化钠的溶液恰好反应完全,另取一份加入含b mol HCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为
| A.(b/10-a/20)mol/L | B.(2b-a)mol/L |
| C.(5b-5a/2)mol/L | D.(10b-5a)mol/L |
由K2SO4和Al2(SO4)3形成的混合溶液,已知其中Al3+的物质的量浓度为0.4 mol·L-1,SO4的物质的量浓度为0.7 mol·L-1,则此溶液中K+的物质的量浓度(mol·L-1)为
| A.0.1 | B.0.15 | C.0.2 | D.0.25 |
用10 mL的0.1 mol·L-1 BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是
| A.3∶2∶2 | B.1∶2∶3 | C.1∶3∶3 | D.3∶1∶1 |
下列说法中正确的是
| A.三氧化硫的水溶液能导电,所以三氧化硫是电解质 |
| B.1 mol·L-1的硫酸钠溶液和1 mol·L-1的氢氧化钠溶液,分别做导电性实验,两种溶液的导电性不同 |
| C.氢氧化铁胶体能导电,故氢氧化铁胶体是电解质 |
| D.在相同温度下,饱和溶液一定比不饱和溶液的导电性强 |
如图所示,两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是
| A.所含原子数相等 | B.气体密度相等 |
| C.气体质量相等 | D.摩尔质量相等 |