下列离子方程式中,正确的是
| A.已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳: ClO-+CO2+H2O=HClO+HCO3- |
| B.硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ |
| C.从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- |
| D.FeCl2溶液中滴加NaClO溶液生成红褐色沉淀:2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+ |
维生素C是一种水溶性维生素(其水溶液呈酸性),结构如下图所示。人体缺乏这种维生素C易得坏血症,所以维生素C又称抗坏血酸。下列关于维生素C的叙述错误的是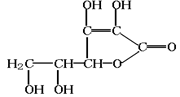
| A.化学式为C6H10O6 |
| B.维生素C分子中含有羟基和酯基 |
| C.维生素C能使溴水或酸性高锰酸钾溶液褪色 |
| D.为减少维生素C的流失,蔬菜最好先洗后切。 |
如图所示,在一熟苹果切片上分别滴上1滴碘水和1滴银氨溶液,颜色变化如图所示,根据这些实验现象的下列推断中正确的是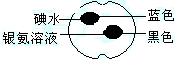
| A.熟透的苹果中含有脂肪 | B.熟透的苹果中不含淀粉 |
| C.熟透的苹果中含有还原性的糖 | D.熟透的苹果中不含还原性的糖 |
下列有关实验操作或叙述正确的是
① 医院用银氨溶液检验某病人是否患糖尿病
② 乙酸乙酯中的少量乙酸可用饱和 溶液除去
溶液除去
③ 淀粉水解时应用浓硫酸作催化剂
④ 在鸡蛋白溶液中滴入浓 ,微热会产生黄色物质
,微热会产生黄色物质
⑤ 在植物油中滴入溴水,溴水褪色
⑥ 用盐析法可分离和提纯蛋白质
| A.①②③④ | B.②④⑤⑥ | C.①③⑤⑥ | D.①②③⑤ |
微量元素 摄入量的多少会直接影响人体健康。导致成人出现甲状腺肿大的原因是缺乏下列元素中的
| A.钙 | B.铁 | C.碘 | D.锌 |
在日常生活中出现了“加碘食盐”、“增铁酱油”、 “富硒茶叶”、“含氟牙膏”等名词,这里的碘、铁、硒、氟应理解为
| A.元素 | B.单质 | C.氧化物 | D.分子 |