短周期元素的单质X、Y、Z在通常状况下均为气态,并有右图转化关系(反应条件略去),已知: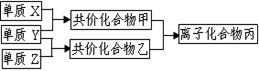
a.常见双原子单质分子中,X分子含共价键最多。
b.甲分子中含10个电子,乙分子含有18个电子。
(1)X的电子式是_______________________。
(2)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲。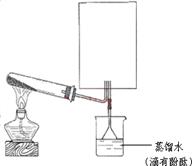
①在图中方框内绘出收集甲的仪器装置简图。
②试管中的试剂是____________________。(填写化学式)
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)_________________________。 (3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,丁的化学式是__________。
(3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,丁的化学式是__________。
在一定温度下将2 mol A和2 mol B两种气体混合于某2L密闭容器中,发生如下反应: 3A(g)+B(g)
3A(g)+B(g)  2C(g)+2D(g),2 min末反应达到平衡状态,生成了0.8 mol D,请填写下列空白:
2C(g)+2D(g),2 min末反应达到平衡状态,生成了0.8 mol D,请填写下列空白:
(1)2min内B的反应速率为_________________
(2)此温度下该反应的平衡常数K=_________________________
(3)如果缩小反应容器的体积,使压强增大,平衡体系中C的物质的量浓度_____________,C的质量分数___________,容器内气体的平均密度________________,平均相对分子质量________________。(填“增大”、“减小”或“不变”)
(4)如果上述反应在相同条件下从逆反应开始进行,开始加C和D各4/3 mol,要使平衡时各物质的物质的量与原平衡相等,则还应加入__________物质___________mol。
由丙烯经下列反应可得到F和高分子化合物G,它们都是常用的塑料。
请回答下列问题:
(1)F的分子式为________,化合物E中所含两个官能团的名称是、。
(2)写出下列反应过程的反应类型:A→B。丙烯→F。
(3)1molA与NaOH的醇溶液反应(生成物仍为卤代烃)的化学方程式为:
;
B转化为C的化学方程式为。
丙烯加聚成高分子的方程式。
C与乙酸在浓硫酸存在下的反应方程式
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。请回答下列问题:
(1)用太阳能分解10mol液态水消耗的能量是_____________kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为________________________;
(3)用甲醇与氧气在碱性条件下形成燃料电池的负极电极离子方程式为_________________
(4)在容积为2 L的密闭容器中,由CO2和H2合成甲醇(CO2+3H2  CH3OH + H2O)
CH3OH + H2O)
在其他条件不变得情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);下列说法正确的是______(填序号)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH) =nA/tA mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时n(H2)/n(CH3OH)增大
(5)在T1温度时,将1mol CO2和3mol H2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为_________________________。
(1)用50mL 0.55mol/L NaOH溶液和50mL 0.25mol/L H2SO4溶液来做中和热测定的实验,测得溶液在反应前后的温度变化为t1℃~t2℃(t2>t1),混合后溶液的比热容为c = 4.18J/(g·℃),溶液的密度都近似为1g/mL,中和热△H=__________(填表达式,不用化简);若将H2SO4溶液换成相同物质的量浓度的CH3COOH溶液,测得的△H______填(“偏大”、“偏小”或“相同”);若将稀硫酸换成浓硫酸来做该实验,测得的△H_______(填“偏大”、“偏小”或“相同”)。
(2)某高能化学物质N2H2内,氮元素的杂化类型为____,电子式为____,一个分子中有σ键个,π 键个。
(3).在密闭容器中进行可逆反应: CO(g)+NO2(g) CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
①增大容器的体积,平衡 移动(填“正向”“逆向”“不”),反应混合物的颜色 。(填“变深”“变浅”“不变”)
②容器体积不变:若通人CO2气体,平衡 移动,反应混合物的颜色 。若通人N2气体,平衡 移动,反应混合物的颜色 。③加入催化剂,平衡 移动。
(4)下表是几种常用燃料(1 mol)完全燃烧时放出的热量:
| 物质 |
炭粉(C) |
一氧化碳(CO) |
氢气(H2) |
甲烷(CH4) |
乙醇(C2H5OH) |
| 状态 |
固体 |
气体 |
气体 |
气体 |
液体 |
| 热量(kJ) |
392.8 |
282.6 |
285.8 |
890.3 |
1 367 |
①从热量角度分析,目前最适合家庭使用的优质气体燃料是________。
②写出管道煤气中的一氧化碳燃烧热的热化学方程式_______________________
③充分燃烧1 mol表中各种燃料,排放出二氧化碳的量最多的是________。
④矿物燃料储量有限,而且在燃烧过程中会产生污染。根据能源多样化的发展战略,我国开发利用的绿色能源有________等。
下列现象不是由平衡移动引起的是()
| A.氯水光照颜色变浅 |
| B.使用排饱和食盐水的方法收集氯气 |
| C.H2、I2、HI平衡混合气加压颜色变深 |
| D.把有缺陷的胆矾晶体,投入饱和的硫酸铜溶液,一段时间后,晶体变为规则结构。 |