【2015海南化学】银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用。回答下列问题。
(1)久存的银制器皿表面会变黑,失去银白色的光泽,原因是 。
(2)已知Ksp(AgCl)=1.8×10-10,若向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020mol·L-1的盐酸,混合后溶液中的Ag+的浓度为 mol·L-1,pH为 。
(3)AgNO3溶液光照易分解,生成Ag和红棕色气体等物质,其光照分解的化学方程式为 。
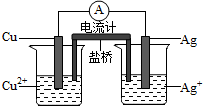
(4)下图所示原电池正极的反应式为 。
有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)写出A、B、C、D、E 5种元素的元素符号
A是________ B是________ C是________ D是________ E是________ (2)D元素在周期表中的位置为_________________________。
(2)D元素在周期表中的位置为_________________________。
(3)用电子排布式表示B元素原子的价电子构型_______________。
(4)元素的电负性的大小关系是BD,(填“>”、“<”或“﹦”),C与E的第一电离能的大小关系是CE(填“>”、“<”或“﹦”)。
(5)A2D属于(填“极性”或“非极性”)分子,其分子的空间构型为。
(6)D、E元素形成的化合物为晶体,电子式为。
m、n、x、y四种主族元素在周期表的相对位置如下图所示。已知它们的原子序数总和为46,则:
(1)元 素n的气态氢化物的分子式为,空间构型为 ,
素n的气态氢化物的分子式为,空间构型为 ,
中心原子的杂化类型是。n原子的价电子排布式是_________ _________
(2)m与y所形成的化合物含 键,属分子。(填“极性”或“非极性”)
键,属分子。(填“极性”或“非极性”)
(3)x位于周期表的第周期第族;其简单离子的离子结构示意图为。
(4)由n、y的氢化物相互作用所生成的物质的电子式为。
某元素的激发态原子的电子排布式为1s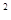 2s
2s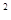 2p
2p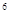 3s
3s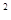 3p
3p 4s
4s ,则该元素基态原子的电子排布式为;元素符号为;其最高价氧化物对应的水化物的酸性比碳酸(填
,则该元素基态原子的电子排布式为;元素符号为;其最高价氧化物对应的水化物的酸性比碳酸(填 “强”或“弱”)。
“强”或“弱”)。
用C、Fe和Al组成的混合物进行如下图所示实验。
填写下列空白。(1)气体X为,固体Z为。
(2)滤液Y中除H+外,还含有的阳离子为和。
(3)滤液N中除Na2SO4和NaOH外 ,还含有的溶质为(填化学式)。
,还含有的溶质为(填化学式)。
简要回答下列问题。洗涤铝制炊具为什么不宜使用酸性或碱性的洗涤剂
。